课题分享
NOX
IGEM 2023 UCAS-China
获奖情况
UCAS-China 2023的NOX项目斩获了IGEM竞赛本科生前十奖最佳新化合物模块和IGEM金奖,同时获得了最佳建模和最佳基础性改进项目的题名。

OVERVIEW
在日常实践中,微量物质检测仍然是一个挑战,尤其是在食品安全和医疗护理方面。
为解决这一问题,UCAS-China团队设计并提出了NOX(基于新型群体感应的表达生物传感器平台),利用合成生物学构建一个人工设计的信号通路,提供了一个高度兼容且性能卓越的稳健平台。
UCAS-China选择了两个例子来展示:
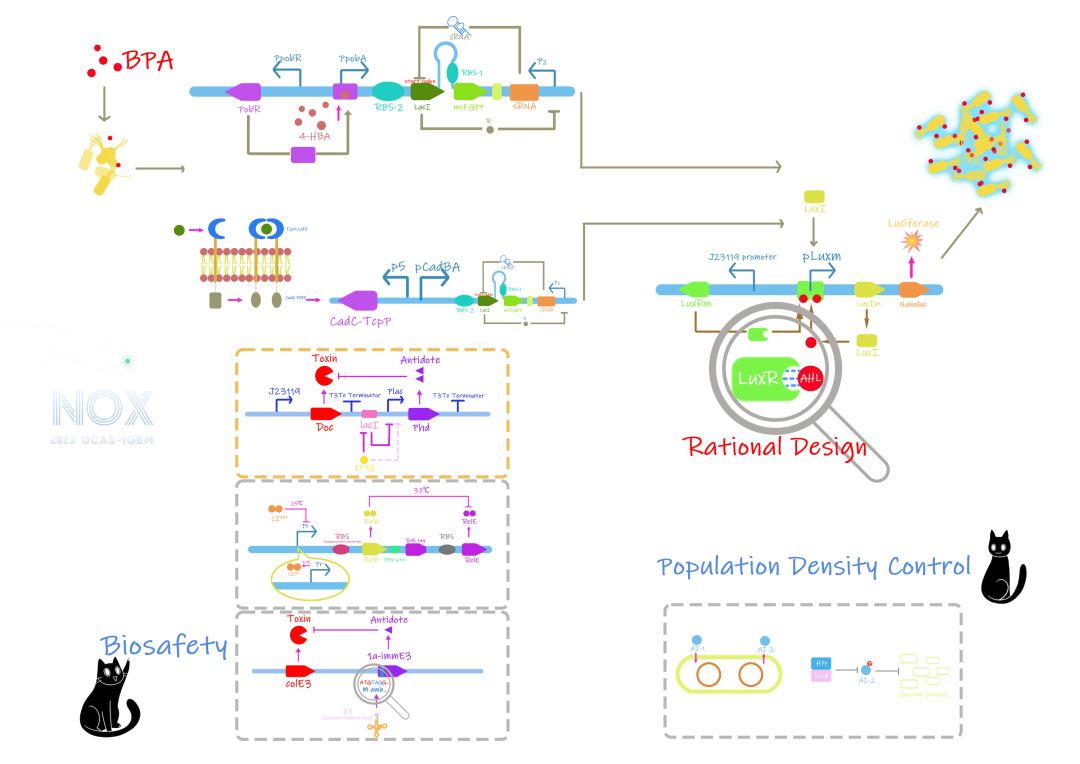
1、双酚A(BPA)通常作为塑料添加剂使用。由于结构与雌激素类似,可能会影响雌激素受体,从而对人体健康造成损害。
2、肝功能障碍影响着数百万人的生活质量。肝功能体外采样诊断仅在医院可用,而其慢性特性需要日常监测。胆盐是肝病的关键指标,其检测至关重要。

DESIGN
首先他们设计了一个“原始阈值保护开关”,通过数字化响应调控表达,实现在输入信号在某一阈值前不表达输出蛋白,达到阈值之后才开始表达。
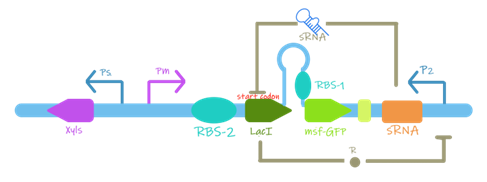
图1.1 阈值保护开关(原装XylS系统)
当诱导物浓度低于阈值时,Pm启动子无法启动转录,下游基因不会表达,同时sRNA通过结合mRNA干扰LacI翻译。由于翻译耦合器的存在: 当 5' 端位置的LacI基因未被翻译时,RBS-1发夹二级结构形成并阻止 3' 端位置GFP基因的翻译。确保了基因不会泄漏表达,开关处于关闭状态。
当诱导物浓度高于阈值时,Pm启动子启动转录,下游的LacI成功翻译,抑制sRNA的生成,从而使GFP能够成功表达,开关处于开启状态。
在original threshold guard switch设计的基础上,UCAS-China舍去了由Xyls与其启动子Ps、Xyls激活的启动子Pm组成的物质识别模块,更换为新设计的、分别特异性识别BPA和胆汁盐的识别模块。由此,UCAS-China可以检测BPA或胆汁盐的浓度是否达到阈值
DESIGN

BPA可以和人体的雌激素受体结合,但是大肠杆菌中却没有相关雌激素受体,无法直接与BPA结合从而用于检测,所以UCAS-China决定先将其分解转化为其他物质,通过检测该物质来实现对BPA的检测。经过文献查阅他们发现BPA对大多数微生物具有高度耐药性,在一种叫做YC-AE1的伪单胞老师株的基因组中,有三个关键基因编码降解BPA的酶。通过引入这三个关键基因可以实现对BPA的转化。具体过程如下:
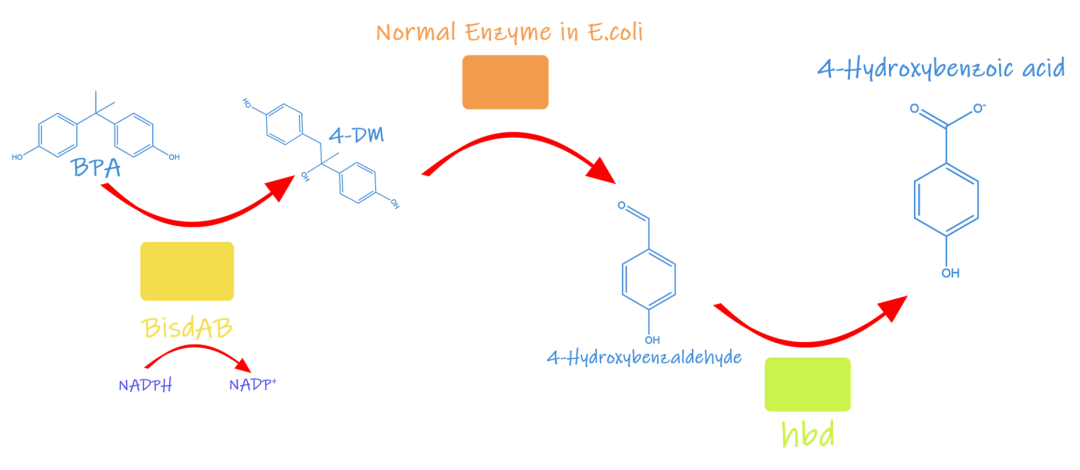
图1.2 BPA转化过程
通过BisdA和BisdB基因将BPA转化为4-DM,随后通过大肠杆菌中常见的酶将4-DM转化为p-甲氧基苯醛。通过第三个关键基因hbd编码的脱氢酶将p-甲氧基苯醛转化为p-甲氧基苯酸(4-HBA),最后通过检测4-HBA来实现间接检测BPA。
4-HBA的检测则是通过一个叫做PobR阈值保护开关的系统来实现的,该系统设计如下:
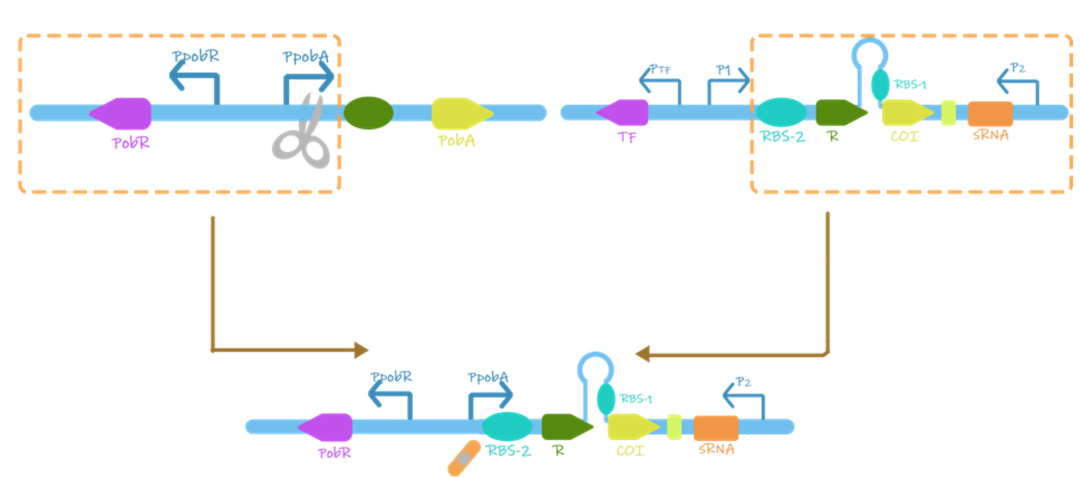
图1.3
PobR阈值保护开关构建示意图
基因pobR能产生一种转录激活因子,一旦将4-HBA引入溶液中,该转录因子就会与其结合,并触发位于pobA侧的双向启动子的转录。该触发机制的优点是即使4-HBA含量很少也可以触发,并且不会触发到其类似物,提高了检测的精确度。又由于pobA基因会编码一种不必要的酶,这种酶可以分解4-HBA。所以UCAS-China选择只截取pobR,pobR的启动子以及pobA侧的双向启动子。至此,UCAS-China实现了对BPA的识别。通过接合到原阈值保护开关上(如图1.3所示),即可检测BPA的浓度是否达到阈值。
同时UCAS-China引入之前的原阈值保护开关,移除了XylS系统(包含XylS蛋白及其对应的启动子)。然后将这两个部分结合起来,最后使用GFP(绿色荧光蛋白)作为测试工具。

Vibrio cholerae是一种寄生性细菌,它通过使用胆汁盐作为肠道定位信号而表现出对胆汁盐的识别能力,因此可以用来充当胆汁盐的生物传感器。在Vibrio cholerae中,TcpP-TcpH主要负责初步胆酸的检测。通过将TcpP-TcpH部分重新编入到工程菌中,并将其与大肠杆菌CadC DNA结合域融合,构建一个重组受体。当该受体被激活后,TcpP-CadC会形成二聚体,并激活pCadBA启动子,合成LuxI并引发传感器的群体感应系统,如图所示。
除此之外还通过将重组后的TcpP-CadC模块引入到阈值保护开关中,以期实现阈值控制和防止漏检的同时效果,如图所示。
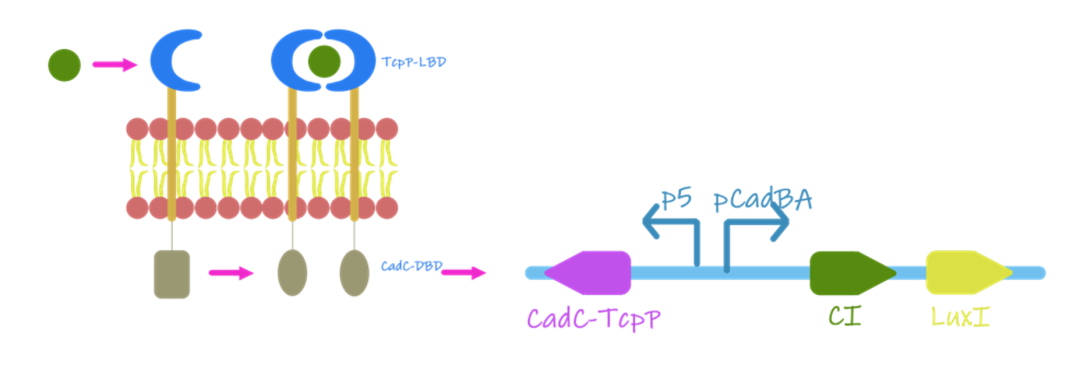
图1.4 CadC-TcpP作用机制的原理图
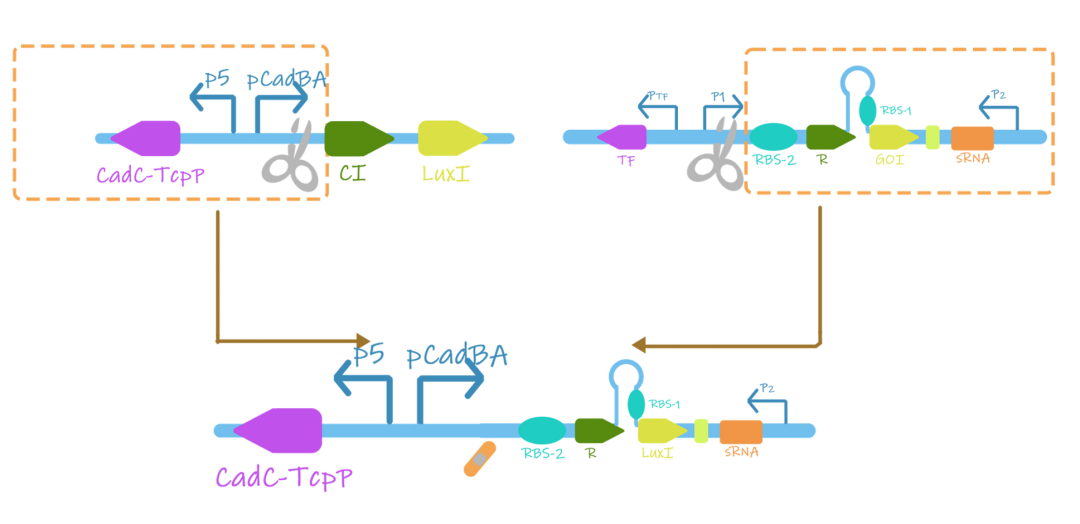
图1.5 CadC-TcpP与阈值保护开关组合构建图

DESIGN
为了实现对于整个装置内目标物质整体浓度的检测,UCAS-China需要排除微环境中目标物质较高对检测体系产生的假阳性现象。故UCAS-China选择将群体感应掺入信号输出的通路设计,以实现对于整个装置内目标物质浓度检测的合计。
群体感应是细菌独有的一种机制,细菌通过产生自诱导剂AHL,与特定受体结合,使下游基因表达。AHL(N-酰化高丝氨酸内酯)是一类经典的自己诱导剂。基于 AHL 的群体感应需要 AHL 合酶和 LuxR 型调节因子,其活性为 由AHL调控。AHL与LuxR 结合后,LuxR二聚化并与DNA 结合,导致下游pLuxm 的转录。
UCAS团队最初提出的设想是使pLuxm的下游存在一个LuxI基因,以构成一个正反馈系统。但相关的研究表明不具有LuxI的回路效率并没有明显提高。因此采用了不含LuxI基因的缩短电路,以降低所设计模块对工程菌的正常代谢的影响。
同时他们使用了突变的LuxR-lux盒系统(称为LuxRm-Pluxm)。由大肠杆菌合成的LuxR无法识别pLuxm启动子,提高该系统的正交性。与野生型LuxR-lux盒系统相比,其转录活性 LuxRm-pLuxm更好,背景表达受到更严格的调节。
所使用的J23119 启动子能持续驱动 luxRm 基因的表达。随着上游通路打开,介质中的自诱导剂开始在狭窄的环境中积累。当培养基中积累了足够多的AHL时,它们可以进入细胞,直接结合 LuxRm 蛋白激活 pLuxm 并下游转录。
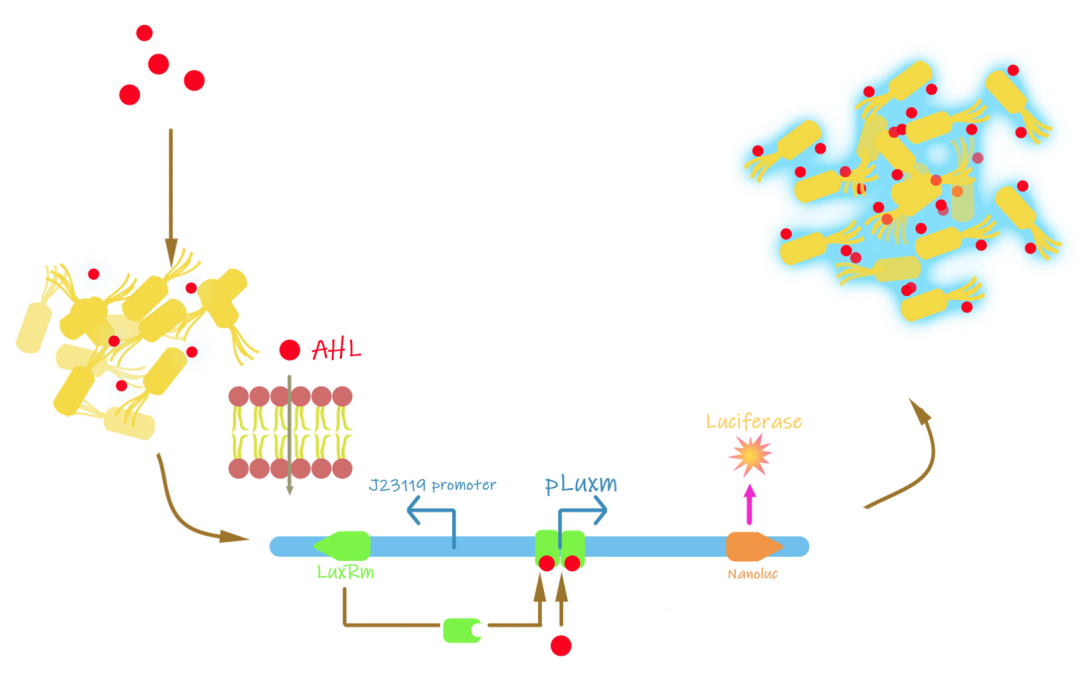
图1.6 群体感应机制示意图
UCAS团队利用Nanoluc作为最终输出的表征,在半开放的检测硬件中加入外源荧光素,当荧光素与Nanoluc表达的荧光素酶结合后会发出荧光信号。这种信号具有更全面的线性范围谱系相关性,背景噪音弱。并且这个荧光十分强,更容易被发现。
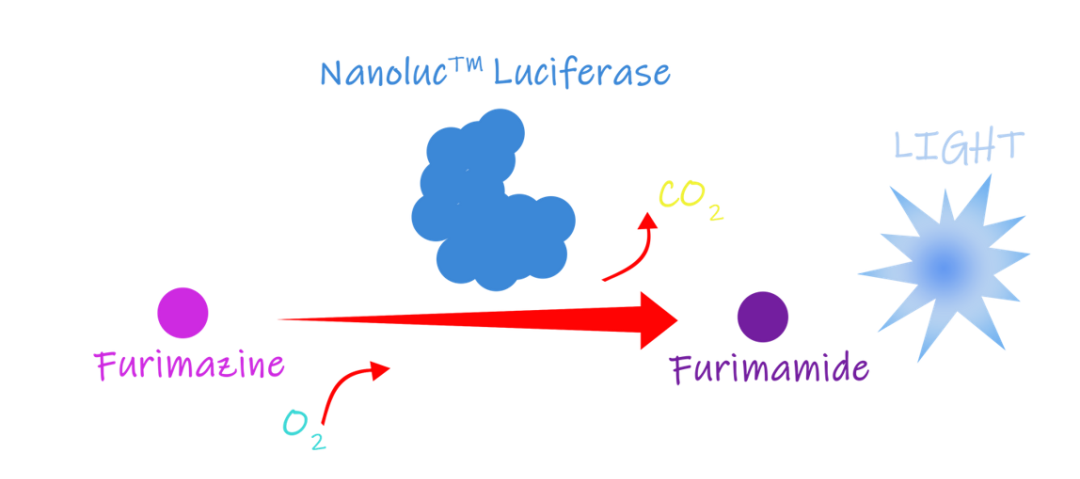
图1.7 纳米氧化机理
在自杀系统部分,UCAS团队提出了IPTG系统以及非天然氨基酸系统两种kill switch。其中依赖IPTG的毒素抗毒素系统为在没有外源IPTG的情况下,LacI会抑制PLac表达,从而无法表达抗毒素,不能抑制毒素,从而导致细胞死亡。而在存在IPTG的环境中,LacI表达被抑制,从而表达抗毒素,维持细胞存活。
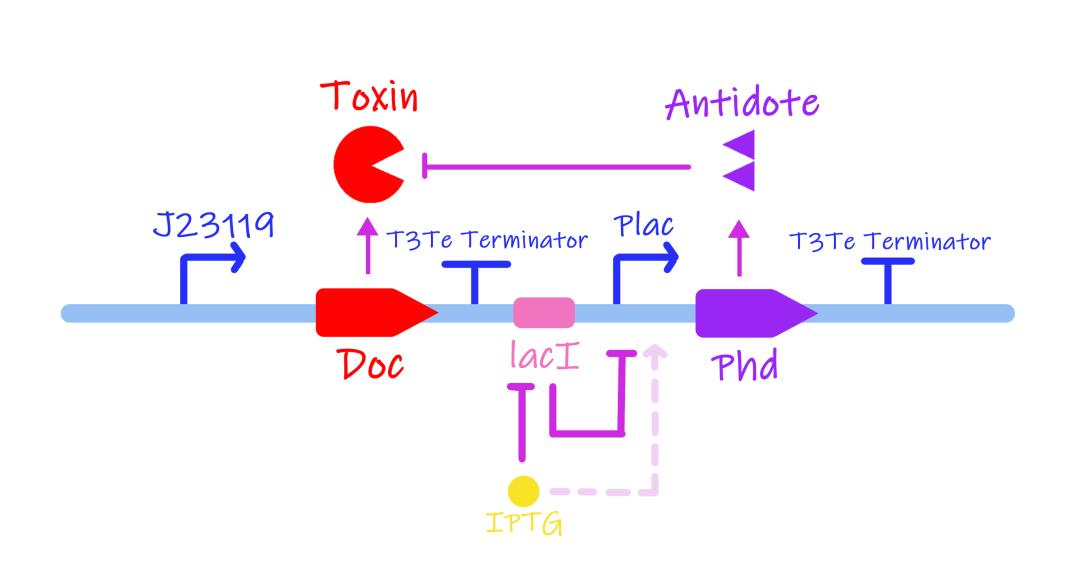
图1.8 IPTG诱导自杀系统
而非天然氨基酸系统则为一种依赖IY的毒素抗毒素系统,在有IY存在的情况下会表达完整的IYtRNA合成酶和Amber SUppressortRNA共同作用,使Amber condon(UAG终止翻译)被替代为非天然的氨基酸,从而使原本终止翻译的部分继续翻译,表达抗毒素维持细胞存活。因此在有IY的情况下细胞才能存活,在脱离IY的环境下会诱发死亡。
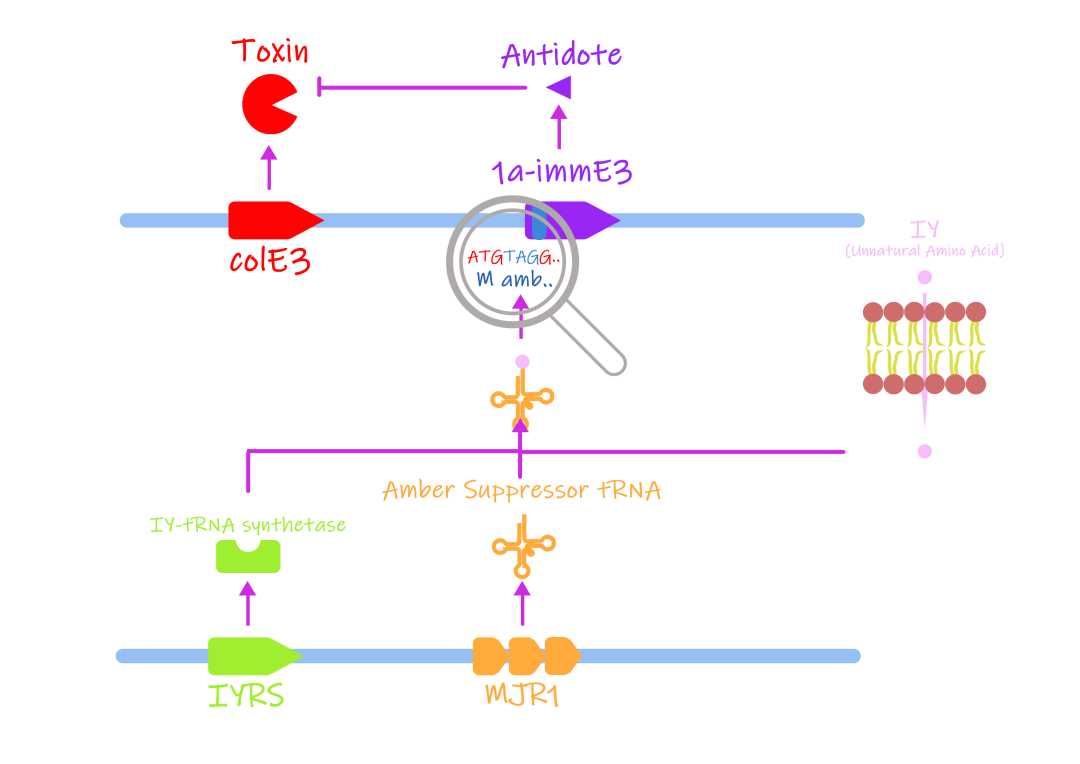
图1.9 非天然氨基酸自杀系统
最终UCAS团队考虑资金与时间因素,最终选择了依赖IPTG的毒素抗毒素系统。
理性设计部分UCAS团队测试了突变的LuxR的群体感应能力和正交性。此外,按照执行计算方法,更深入地了解了 LuxR-VAI 交互的结构基础。
他们搜索了LuxR和VAI的结构,进行分子对接,并分析VAI与氨基酸残基之间的相互作用。
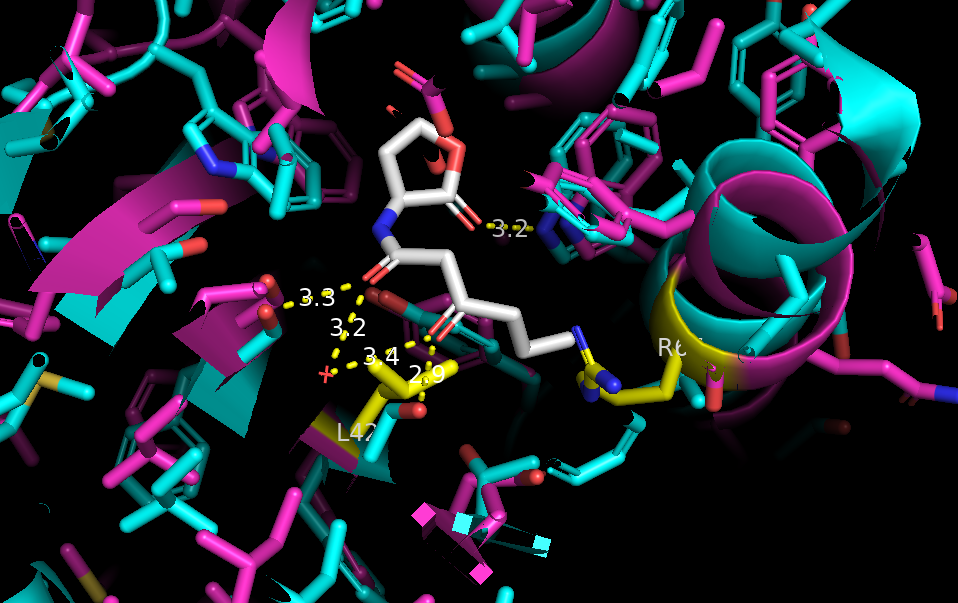
图1.10 分子对接通过分子对接预测的 VAI-LuxR 相互作用
自我更新
为了实现工作状态与恢复状态的模块响应分离,设计了一个温度介导的工作模块使大肠杆菌能够获得在基础水平表达 LuxI 的能力,从而启动群体感应。然而,当系统运行时,LuxI 的基础水平表达应该终止,并且在恢复阶段,LuxI 应该再次表达。
将37℃设计为工作温度,将25℃设计为恢复温度。温度较高(>37℃)时,RNase E cleavage site(RC)被剪切,终止下游表达。较低温度(<27℃)时,Anti-RNaseE cleavage site(ARC)竞争RNaseE,使之结合ARC而不剪切RC,启动RC下游表达,因而LuxI可以在恢复状态正常表达,在工作状态关闭表达。
细菌密度会影响荧光强度,为实现半定量检测需控制细菌密度,此处团队使用了广泛存在于真菌与古菌中在糖消耗和代谢中起重要作用的磷酸转移酶系统(PTS)。其中,酸性磷酸载体蛋白HPr和突变体LsrK可形成共晶结构,抑制LsrK活性,使其无法正常磷酸化自体诱导物2 (autoinduction-2, AI-2),阻碍群体感应正常进行。若细菌处于稳定生长状态时,HPr 受到磷酸化,与 LsrK 结合能力降低,AI-2能正常被磷酸化,群体感应正常。团队引用Stephens 等人的研究,应用了响应AI-2信号并产生AI-1信号分子翻译产物的系统,以及基于AI-1 信号水平调节细老师落生长速率的控制系统,得到自主控制工程菌稀疏密度的方法
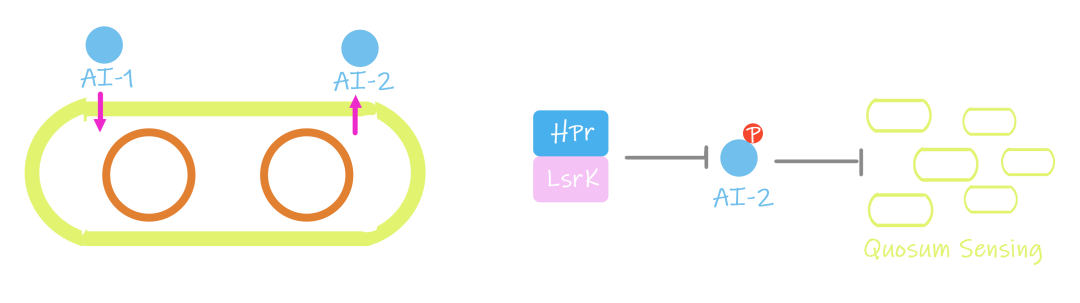
图1.11 种群密度控制
此外还设计了一个温度介导的自杀系统,实现在25-37℃之间的温度特异性表达,并且希望借助数学建模,实现端对端建模,具体内容详见wiki

RESULTS
首先,UCAS-China对原始XyIS阈值的具体阈值浓度和可行性进行了验证,具体实验方案是用苯甲酸和3-甲基苯甲酸进行0-2000μM梯度的浓度测试,用酶标仪检测GFP荧光,每两分钟测量一次,共检测十二小时。对数据归一化处理后发现其阈值在150μM和100μM之间。
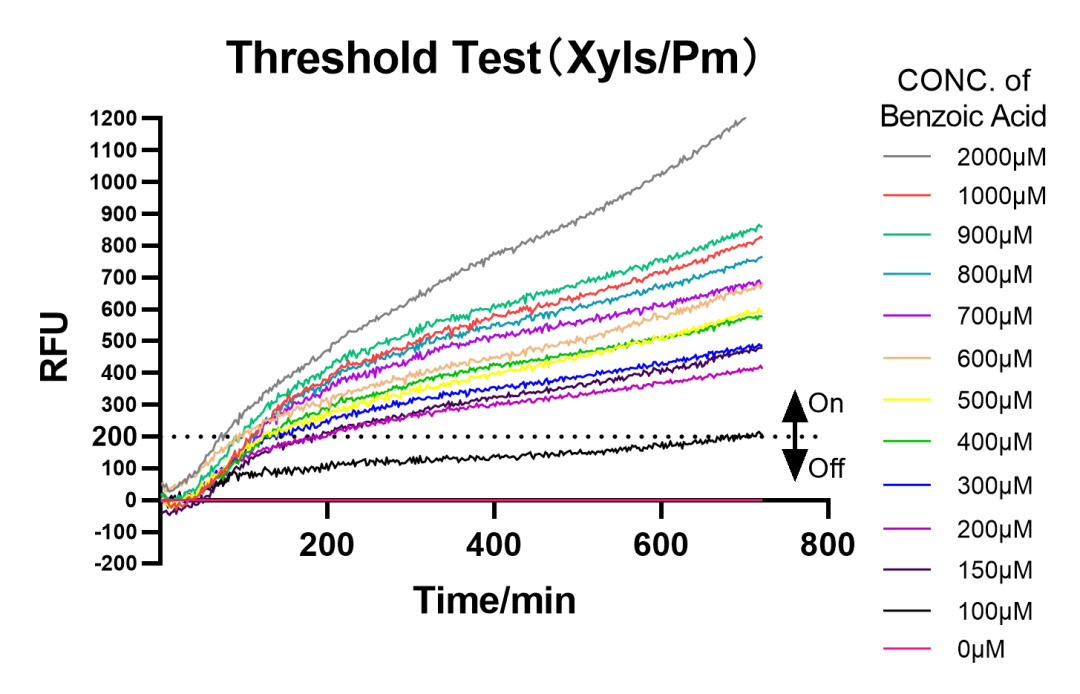
图2.1 0μM-2000μM苯甲酸浓度梯度测试
同时,对各苯甲酸浓度下开关的响应时间作图,发现响应时间较预期偏长。即使在苯甲酸浓度为2000μM的情况下,开关达到导通状态的最短时间也达到了 74.33分钟。
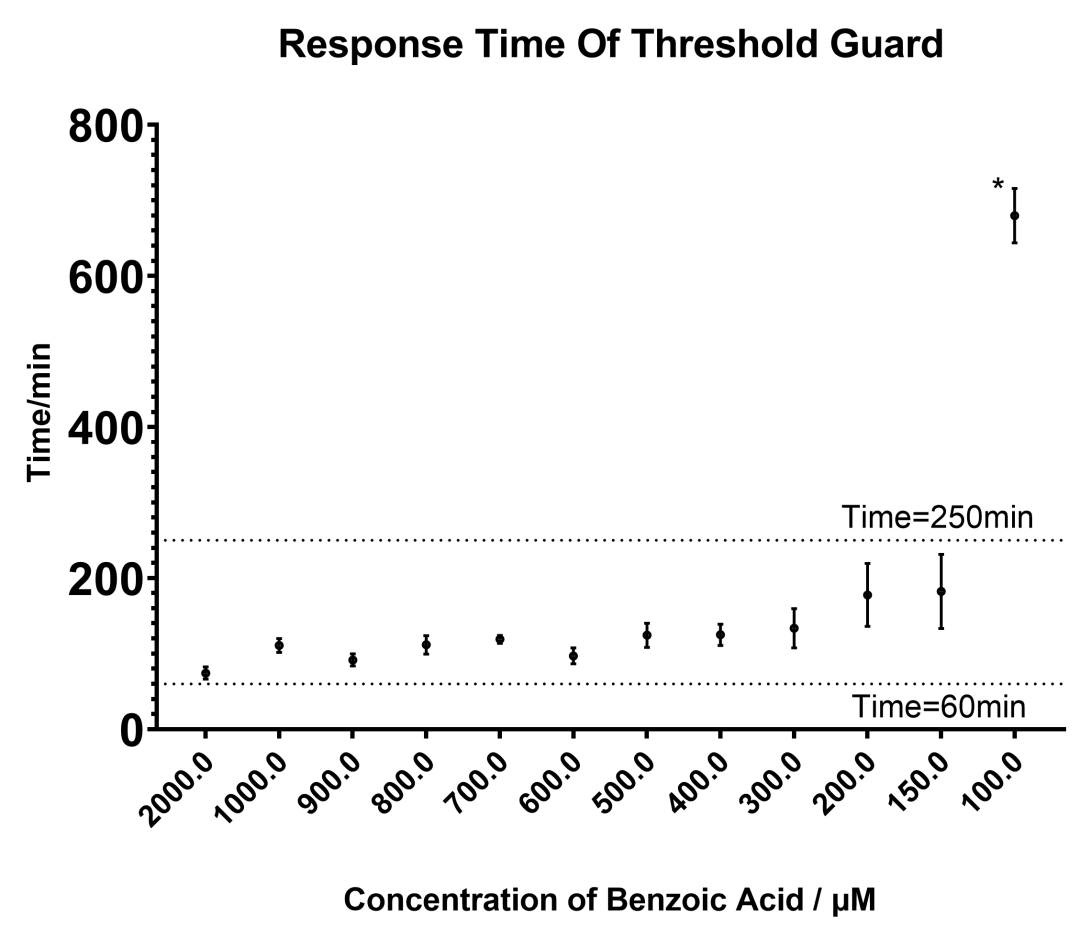
图2.2 原始阈值系统随时间相应图
为进一步确定阈值,设计了80μM到150μM梯度的实验,进一步精确了阈值在100μM-110μM之间,并且证实了该模块的准确性。
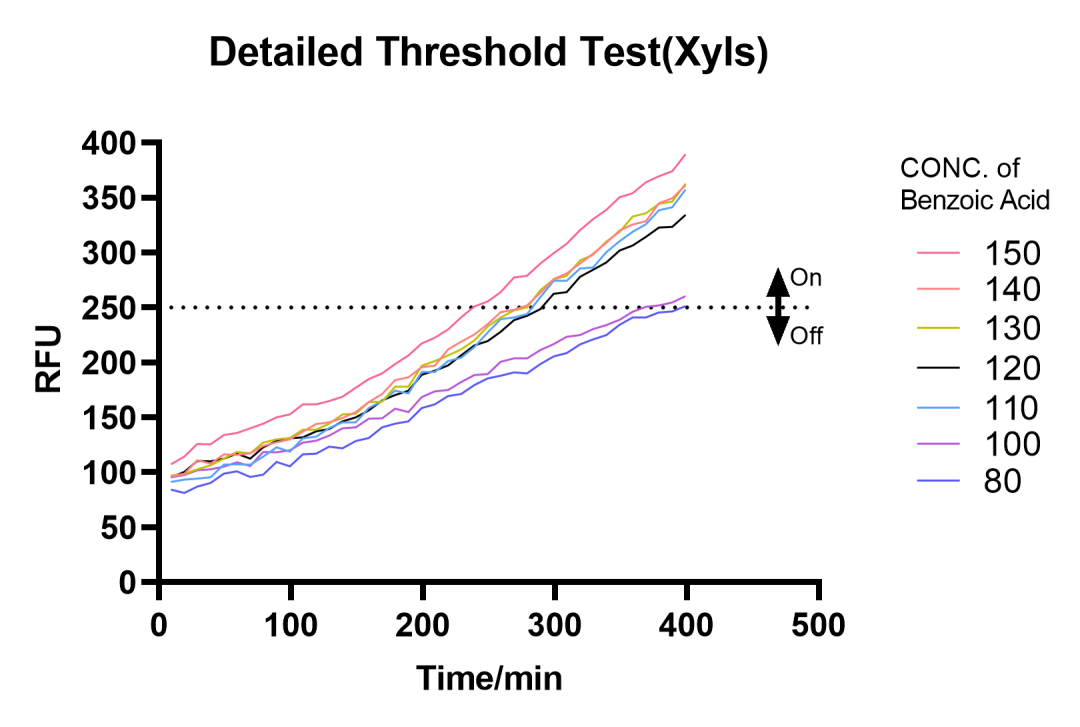
图2.3 80μM~150μM苯甲酸浓度梯度测试
之后,UCAS-China用同样的方法测定了BPA检测系统的阈值,测得其在0.2-0.3之间。
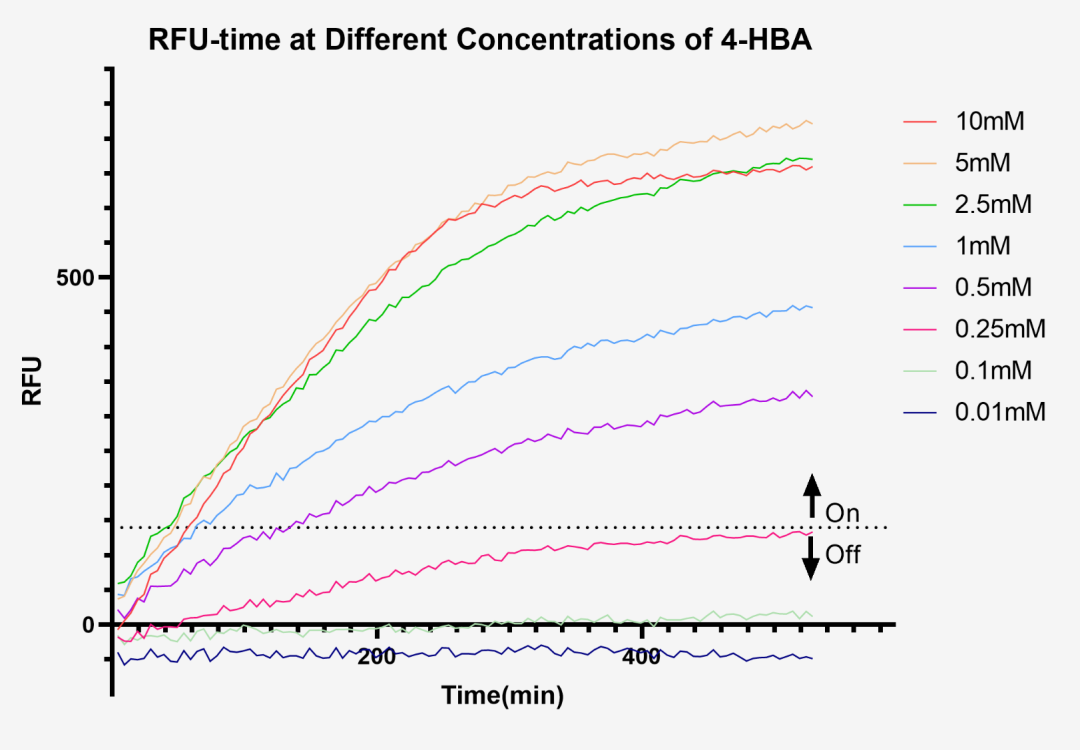
图2.4 不同4-HBA浓度和时间对msfGFP荧光水平的影响
在激发光波长为485nm(±20 nm)、发射光波长为520nm(±20nm)的条件下,测量了不同浓度4-HBA下msfGFP的表达量随时间的变化情况。根据上述结果可以看到在0.25mM处开启开关。
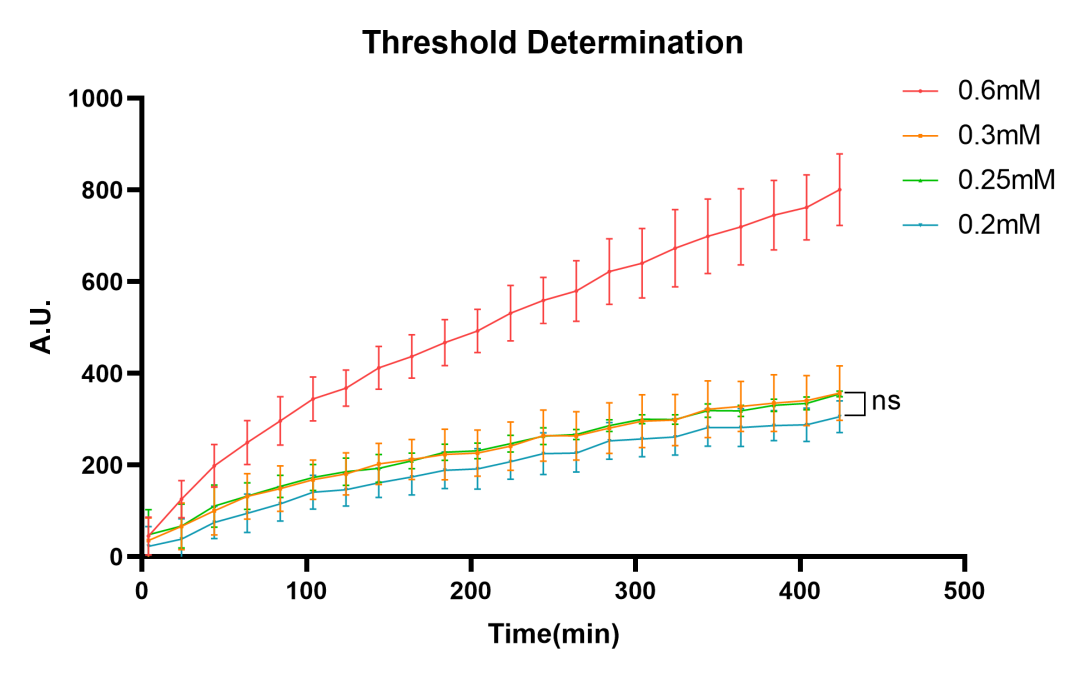
图2.5 .PobR阈值转录开关详细阈值测试
进一步确定PobR阈值转录开关的具体阈值,进行了一个使用较小浓度4-HBA的实验。该实验中采用的浓度包括0.6mM、0.3mM、0.25mM和0.2mM。结果表明,预期潜在的阈值(在模型预测范围内),位于0.2mM至0.3mM之间。
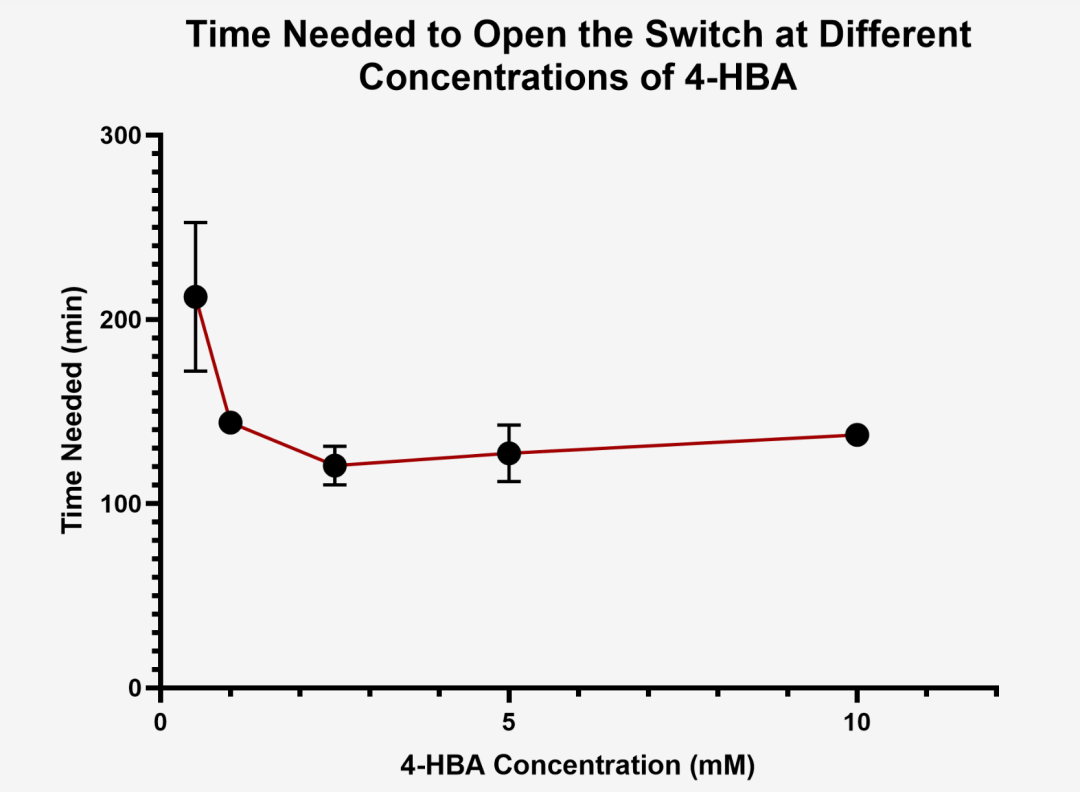
图2.6 不同条件下开关开启时间测试图
同样测定荧光诱发的时间,发现当浓度为0.5μM至10μM的范围内时约需要120分钟
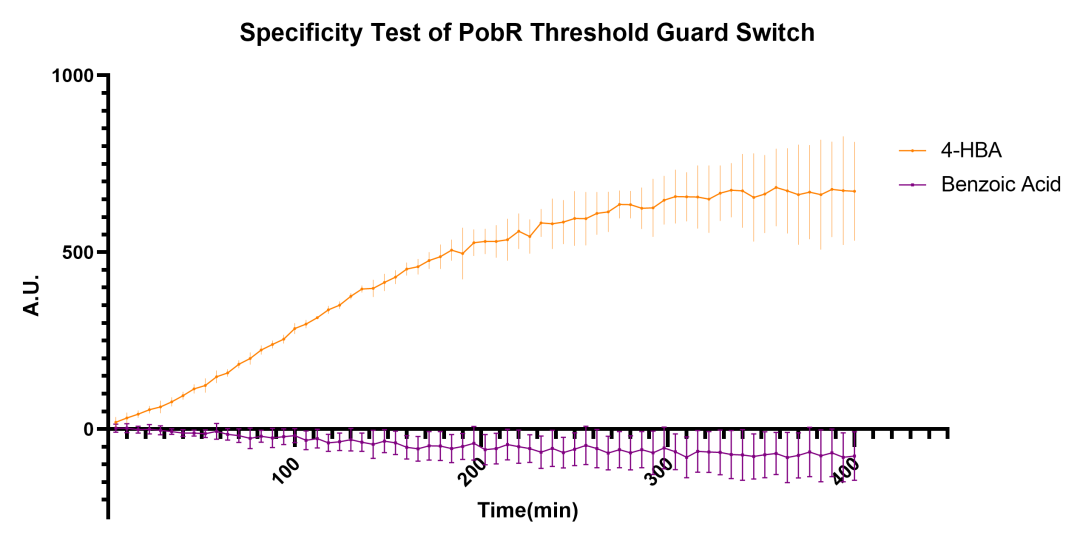
图2.7 PobR系统对4-HBA和苯甲酸的响应测试图
进一步验证了该阈值调控模块只对4-HBA有反应,对苯甲酸没有特异性。
对于控制泄露进行有效性检测
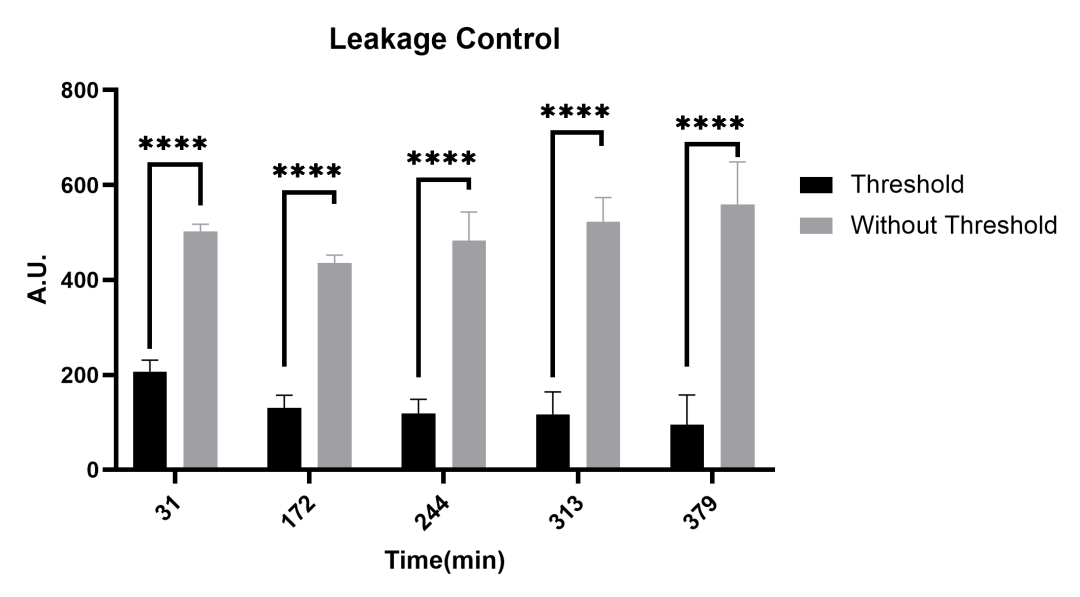
图2.8 两组E.coli中msf-GFP 的A.U.值

图2.9 两组E.coli所发出的大肠杆菌荧光照片
在没有添加诱因的情况下,实验测量了两组E.coli(大肠杆菌)所分泌的msf-GFP的A.U.值(A.U.=(荧光强度-基线荧光强度)/OD600)。上图说明加了阈值开关的显著降低了漏检,甚至可以用肉眼看到这两种群之间的差异。这些结果表明,在阈值转录开关的帮助下,大多数的泄漏和假阳性现象都可以被消除。
接着对群体感应模块进行了验证:
首先检测了有无luxI正反馈对群体感应系统效率的影响,将大肠杆菌在培养基培养之后用AHL诱导,检测荧光图谱发现在同一浓度下基本没有差异,认为有无luxI对实验结果并无影响,因此选用了无正反馈的短通路。
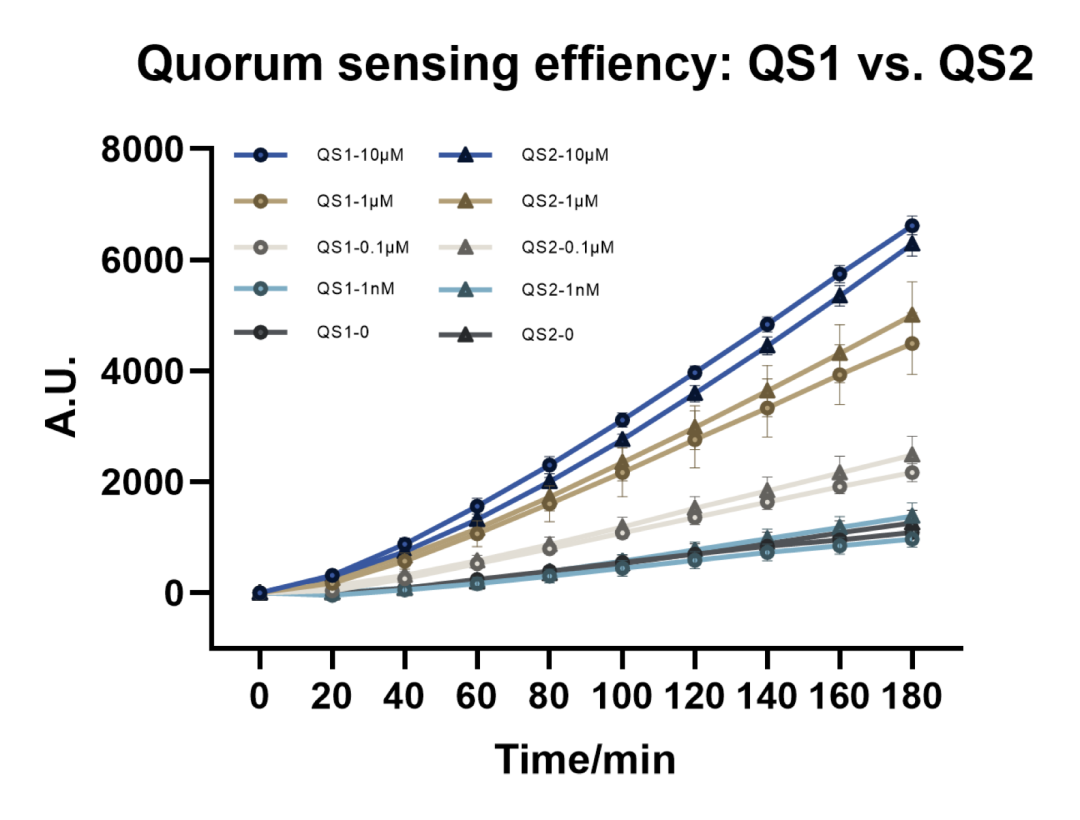
图2.10 群体感应效率检测。(注:
QS1组带LuxI,QS2组不带LuxI)
接着对系统的信噪性能进行检测,将加入了正确的AHL和未加AHL的空白组进行对照,检测荧光强度。
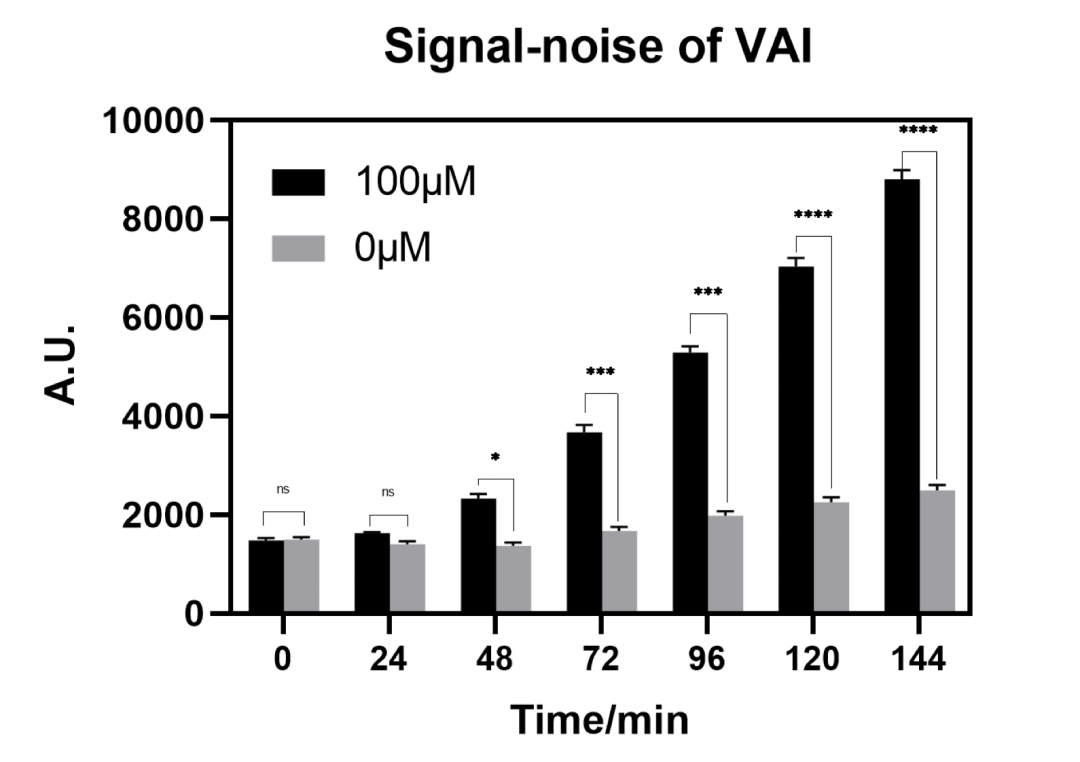
图2.11 群体感应系统的信噪比与时间
100μM的VAI在48min后相较于空白组产生明显信噪比,信号显著。
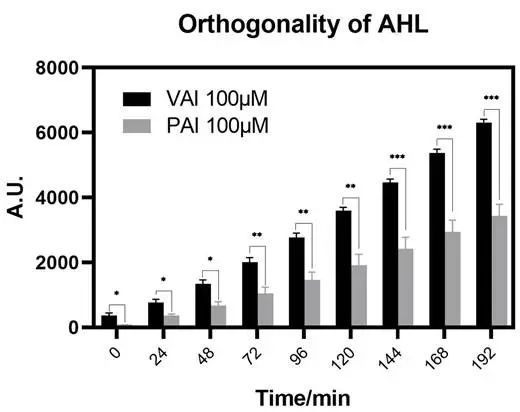
图2.12 两种AHL的正交性检验
对VAI和PAI的正交性进行检验,发现加入VAI的荧光信号高于加入PAI,说明系统不易受到干扰LuxR影响,正交性较好。
最后对最终的群体感应系统进行检验,可以发现有明显荧光出现。

图2.13 荧光显微镜下的群体感应效应
将Nanoluc基因置于一个质粒中,该质粒在IPTG的诱导下能够表达Nanoluc。
用IPTG诱导4h后发现加入了荧光素的荧光信号组高于阴性对照,说明了Nanoluc产生荧光信号用来表征的可行性。
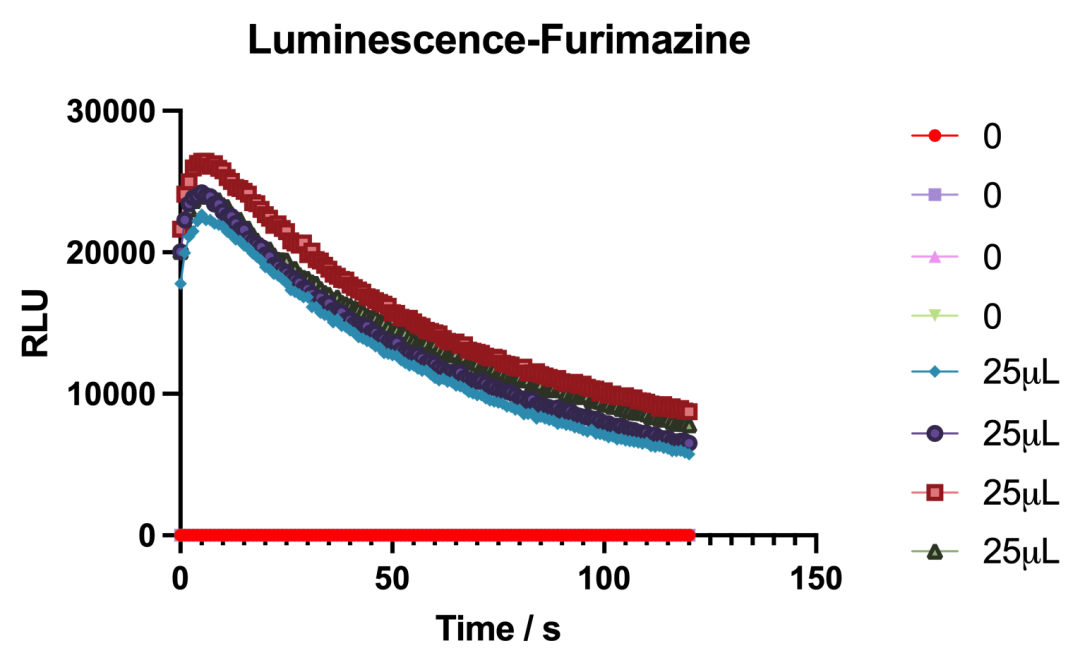
图2.14 发光时间跨度图的结果
最后对理性设计部分进行验证:
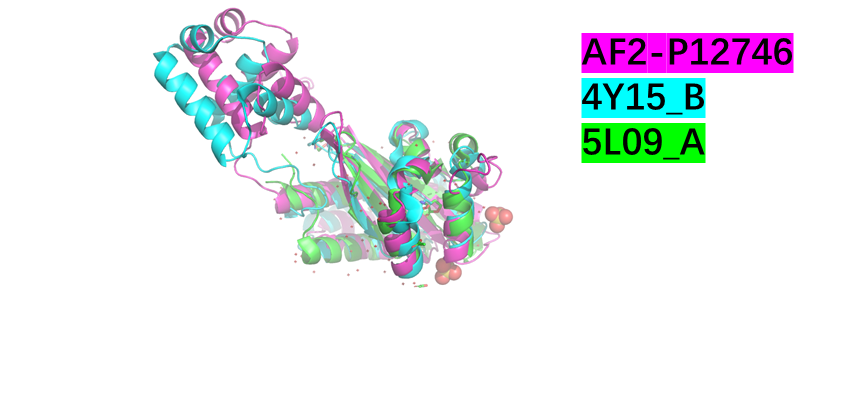
图2.15 分子对接结果图
分子对接结果显示,VAI在LuxR中的位置相对一致,表明存在核心的极性相互作用。
在结合过程中,酰胺基团的氮和丝氨酸的羟基之间形成氢键,或者结构水与丝氨酸的羟基之间形成氢键。
基于对AHL和蛋白质相互作用的理解,提出了两种可能的突变设计:Leu 42 to Ser和Arg 67 to Val。这些突变旨在提高LuxR与VAI结合的特异性和效率。

DryLab ---Model
在干实验建模部分,UCAS-China主要按照以下五个板块的划分开展工作。
首先是基础但至关重要的三条回路的建模,分别为自我恢复(self-renewal)回路设计,阈值保护开关(threshold guard switch),以及基于 IPTG的自杀系统设计。
在第二板块中,UCAS-China对物质扩散过程进行了可视化建模。他们利用了基础物理学定律刻画扩散,并开发了一个APP交互界面,用二维图片展示客制化的扩散过程。
第三板块是校准曲线的建模。UCAS-China基于经典的自动化控制理论,利用多个过度函数类型刻画所设计回路的表达过程,并希望所刻画的曲线能较好地贴合湿实验数据,并精确展示诱导物与报告基因间关系。
在第四板块,UCAS-China则对硬件的大小设计与所设计的检测系统间互作进行预测,并获得了最合适的容器大小。
在最后一个板块,UCAS-China则着眼于与湿实验的数据交换,做了数据的拟合。做出了设计Threshold guard的阈值、计算further modeling的抑制系数等工作。
A.Completely Positive Feedback Design
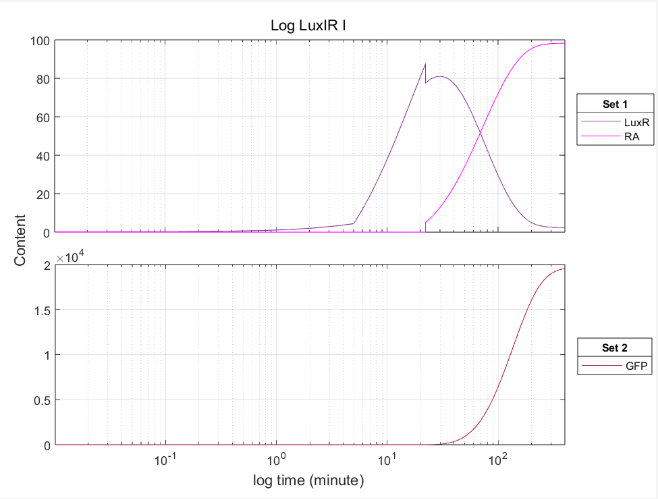
图3.1 正反馈设计中 LuxR 和 GFP 的量与触发后的时间关系
使用对数时间轴可以看出,添加触发器后,LuxR、RA和GFP从前到后上升,并有一定的滞后。但在对数坐标中,可以看到滞后作用是10 -20秒。这是第一个基因系正反馈的时效性。
B.Self-renewal Design
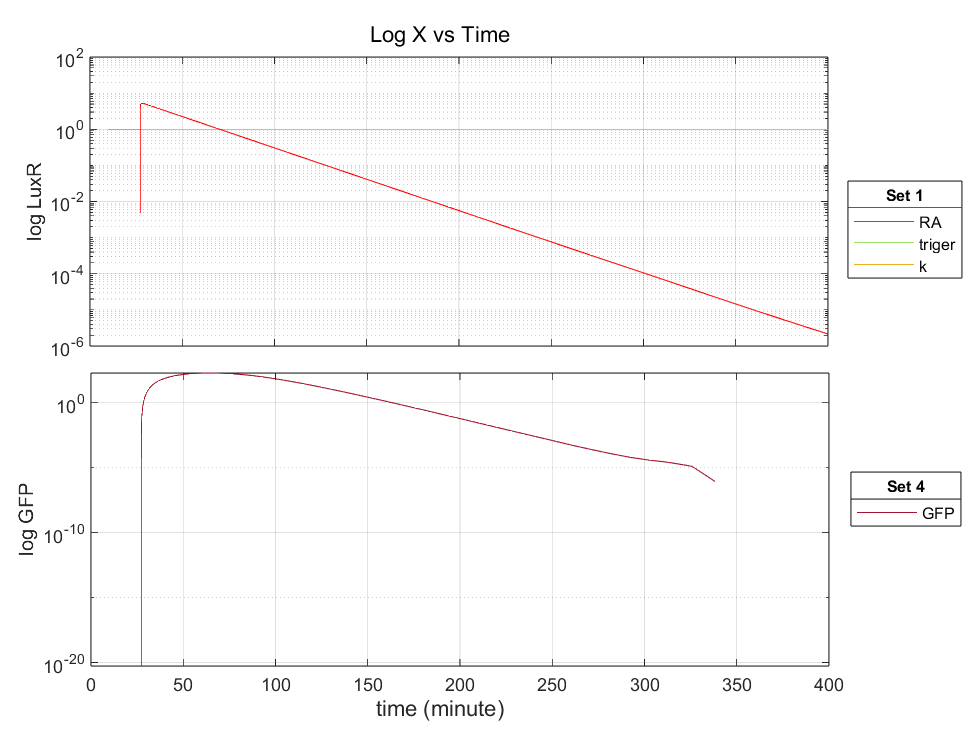
图3.2 自我更新设计中LuxR和GFP的量与触发后时间的关系
通过负反馈机制实现 LuxR 的自更新,确保系统的可重复使用性。
关键机制:在 luxI 下游表达 cl ,抑制 LuxR 的生产,从而在触发后保持 LuxR 的总量恒定。
实验结果:与完全正反馈设计相比,自更新设计在触发后 LuxR 和 GFP 的浓度呈指数下降,最终低于 0.1,显著降低了成本。
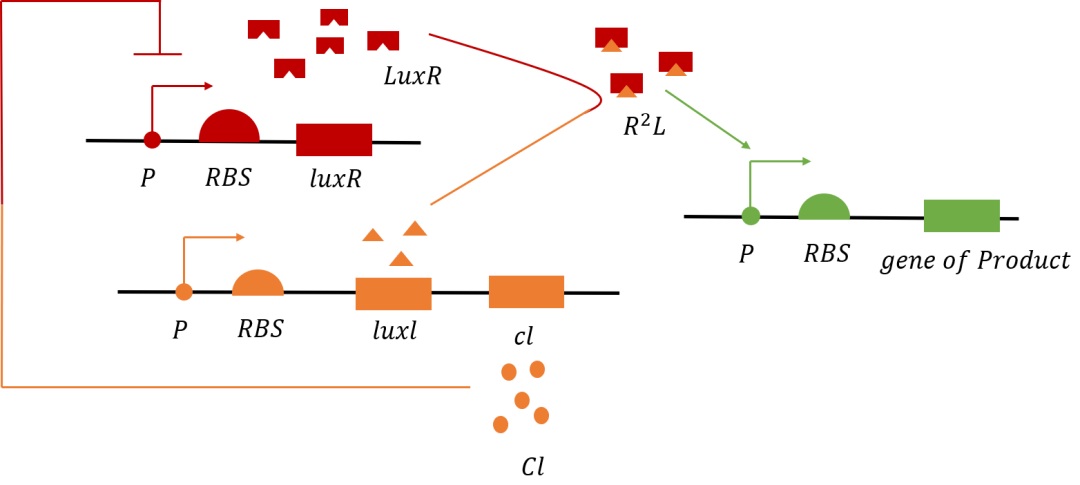
图3.3 自我更新设计的整体电路
C.Threshold guard
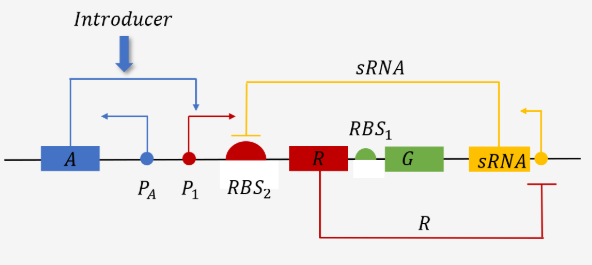
图3.4 Threshold Guard 的整体电路
只有当诱导剂强度超过一定阈值时,系统才会被激活。
关键机制:利用 sRNA 和转录抑制因子 R 的协同作用,确保系统的正交性和灵敏度。
实验结果:通过计算机模拟和实验验证,确定了阈值约为 680,抑制系数超过 10 倍单位强度,证明了系统的高效性。
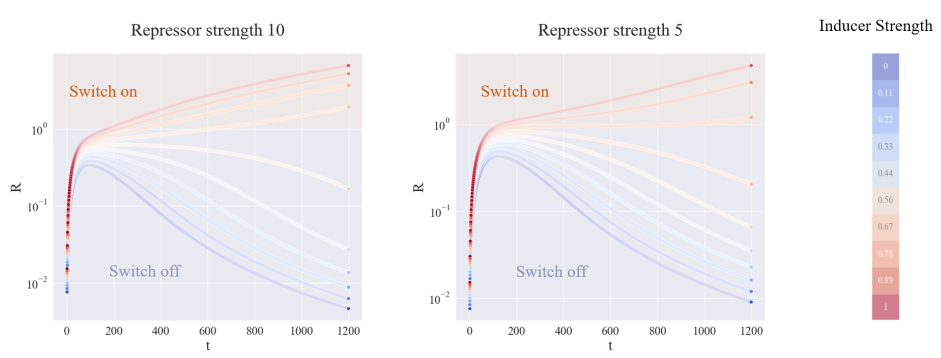
图3.5 不同触发器下稳定状态下的 R 与 mS 的量
从上图可以看出,有了诱导剂,当抑制强度越强时,平衡时R的个数也会越大。相反,在没有诱导剂的情况下,抑制强度越强,平衡时的mS数也越多。这表明在正交设计中,两种抑制因子将在不同的状态下工作。
为了测试阈值保护的灵敏度,并且为了减少计算成本的消耗,UCAS-China使用上张图中的结果,并相应地将抑制强度设置在5到10之间。然后将控制一组诱导电平,看看R的量如何随时间变化。

图3.6 不同诱导剂强度下的 R 量与时间的关系
从上图得到合适的诱导剂水平,并将诱导剂水平设置在 0.56 和 1 之间
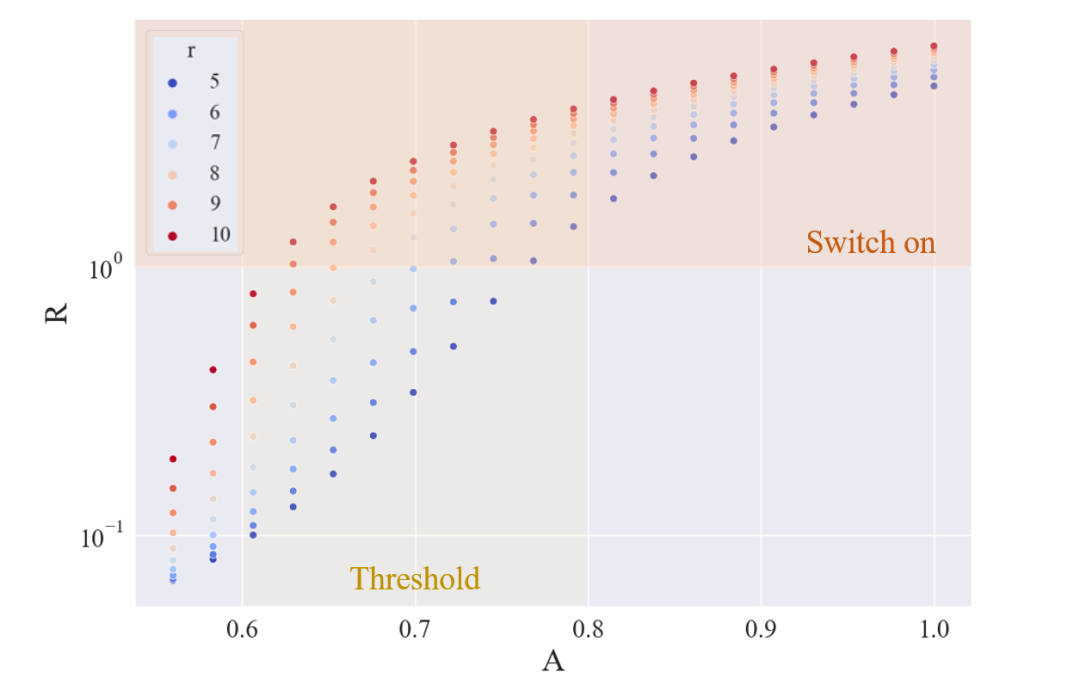
图3.7 不同阻遏物强度下稳定状态下的 R 与 A 的量
UCAS-China预期阈值约为最大诱导量的70%,为湿实验室设计了一个实验,惊奇地发现了真实的阈值,并确定其强度为680umol/L,并测量了阻遏物的粗糙强度超过10。
Diffusion Model部分
模拟生物分子在细胞内的扩散过程,帮助优化实验设计和硬件布局。结合热扩散原理和计算机视觉技术,通过二维图像的卷积处理,实现扩散过程的可视化。基于分子的热运动,模拟分子在细胞内的随机扩散过程。使用离散形式的扩散方程,将扩散过程分解为多个时间步长,逐步计算分子浓度的变化。
将细胞环境划分为二维网格,每个网格点代表一个局部区域。通过迭代计算,模拟分子在不同网格点之间的扩散,最终得到整个细胞内的浓度分布。
利用计算机视觉技术,将扩散过程可视化为二维图像。通过卷积操作,处理图像数据,增强扩散效果的可视化效果,使研究人员能够直观地观察分子的扩散路径和浓度变化。
(动图分辨率太高加载不出来)
在校准模型这一部分,UCAS-China使用了控制论进行建模。他们将多种生物过程,诸如基因的转录与翻译,都抽象为控制论中的传递函数。在此基础上,他们建立了频率域与时间域的映射关系,以刻画整体过程。
对于转录与翻译,UCAS-China将该过程抽象为
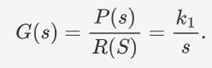
对于基因降解,UCAS-China则将其抽象为:
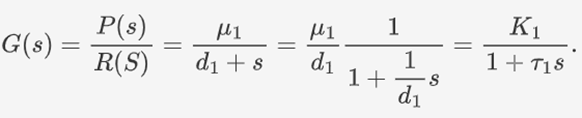
在此基础上,若结合转录与降解两过程,则可获得传递函数为:
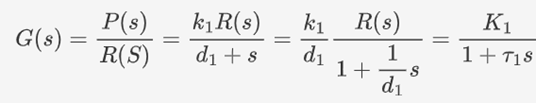
此外,他们将输入源进行了分类,并进行了刻画。对于常数型输入源,UCAS-China用
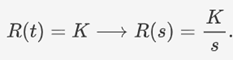
这一传递函数进行刻画。
下图为常数型输入的示意图。
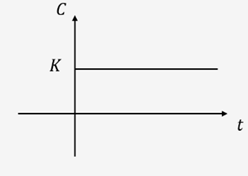
对于周期型输入源,UCAS-China则用
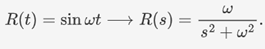
这一传递函数进行刻画。下图为周期型输入的示意图。
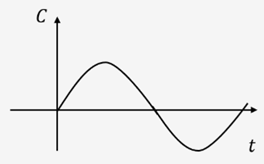
此外,UCAS-China使用了Simulink对基于LuxR-AHL系统的self-renewal部分过程进行了仿真模拟。UCAS-China先拆解该系统为若干模块,再整合为统一系统。
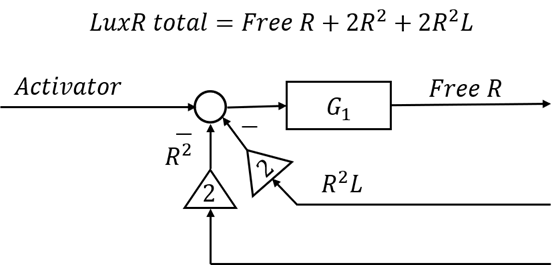
LuxR模块用于描述LuxR蛋白的生成与降解,运用了转录、翻译、降解环节的传递函数进行构建。
AHL模块则用于描述输入激活状态LuxR(R2L)启动相应的过程。
在上述两个模块基础上,UCAS-China利用了泰勒公式对上述模块的模型进行线性化处理,以利于经典控制理论分析。
线性化结果:
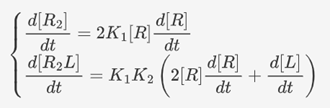
通过一系列具体改动,可获得整个系统的框图以及对应的结果:

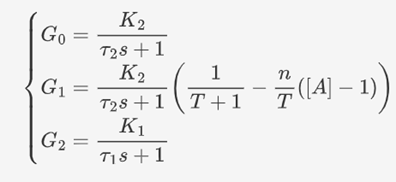
UCAS-China借助Simulink构建了相应的单输入单输出(SISO)系统,可模拟不同输入下系统的响应,帮助分析所作设计的有效性。具体的模型如下。
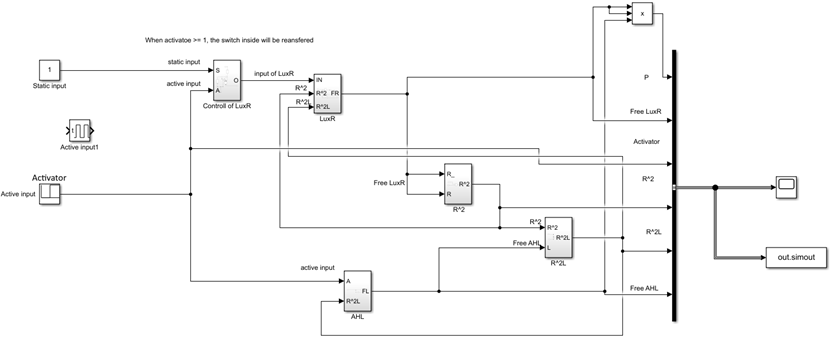
仿真结果如下。
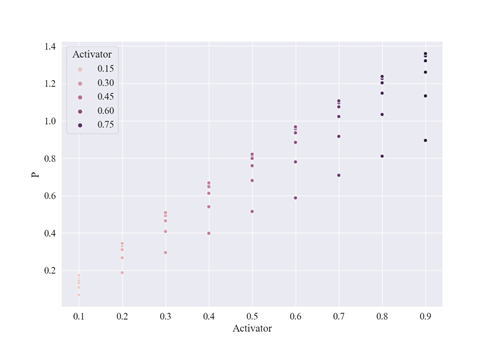
图3.8 稳定状态下产物vs诱导剂(P:产物,Activator:诱导剂)
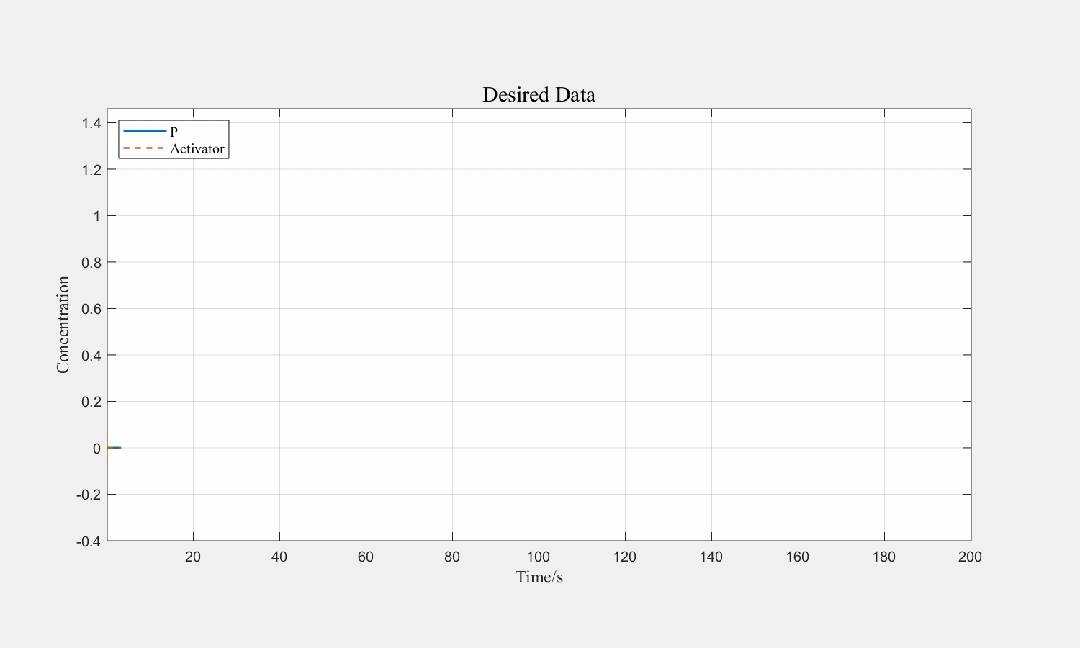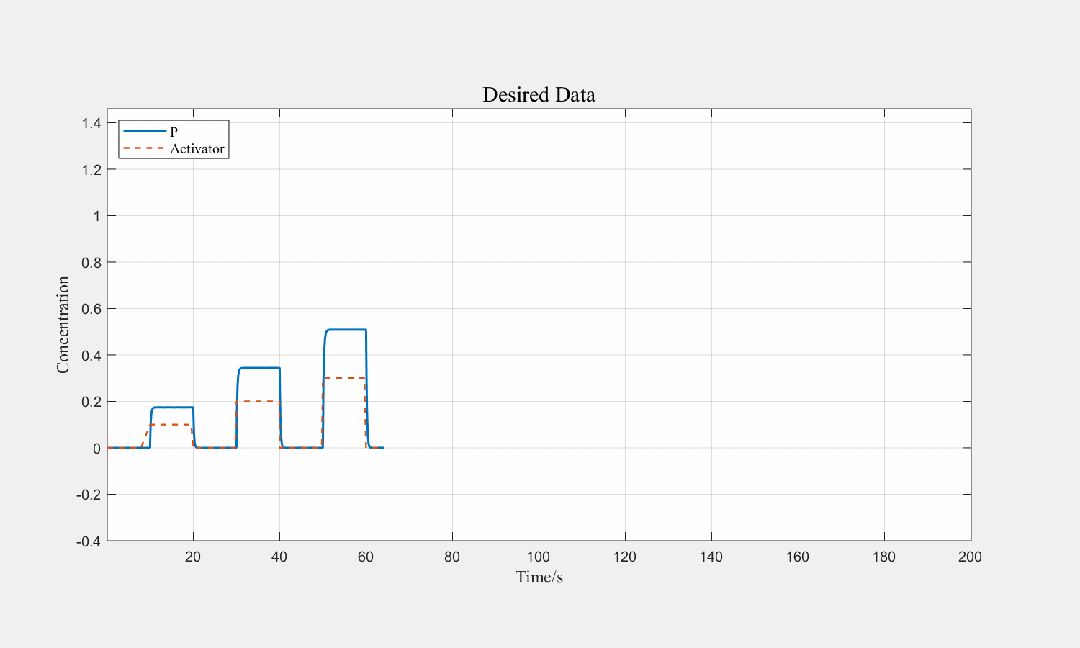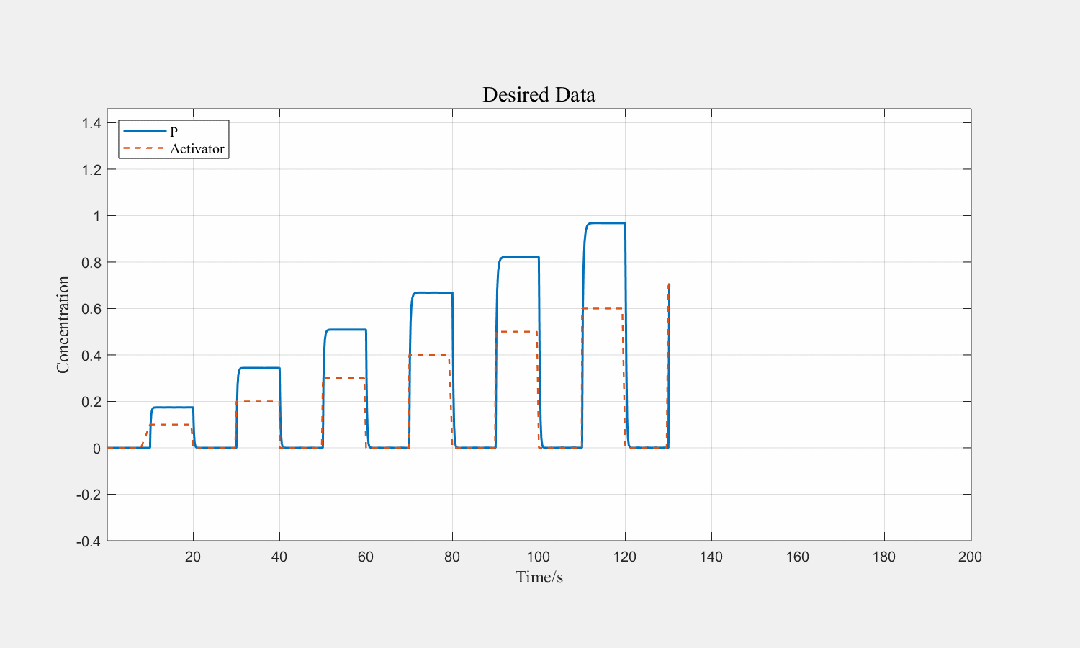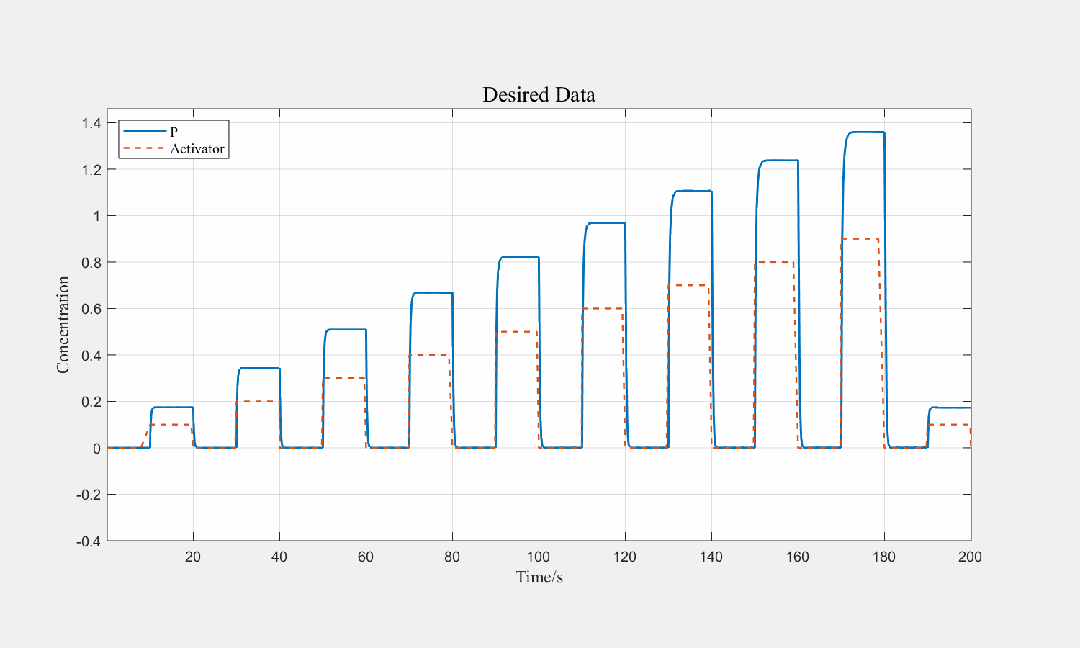
图3.9 不同步长输入条件下,产物关于时间的关系图
UCAS-China运用了COMSOL多物理场对反应仓内分析物的扩散和发光效应进行建模预测,评价了不同的反应仓形状对荧光发射的影响。
为简化过程,UCAS-China将分析物的扩散是为流体运动,并追踪流线(streamline)与通量(flux)随时间的变化。
UCAS-China通过分析物的分布情况来测算特定时间光敏电阻处检测到的光强度,作为检测硬件模块设计效果评价的标准。
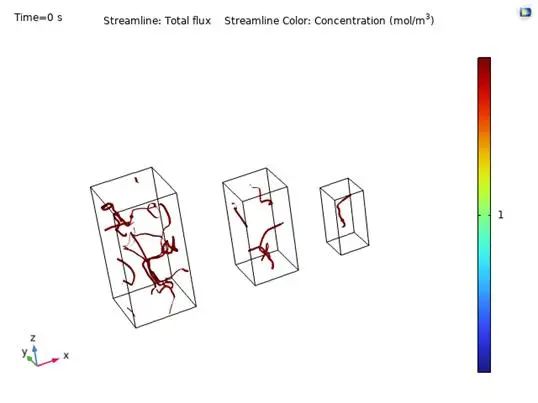
图3.10 不同容器大小
简化后流体力学模型表明:容器越小,流线越稀疏,但价格较低。考虑到价格,故选择使用中等大小容器,即0.2 x 0.2 x 0.4。在选择好容器规格后,UCAS-China通过选用了容器表面一个小方格作为扩散起点,进行三维模型内的荧光强度预测。结果如下。
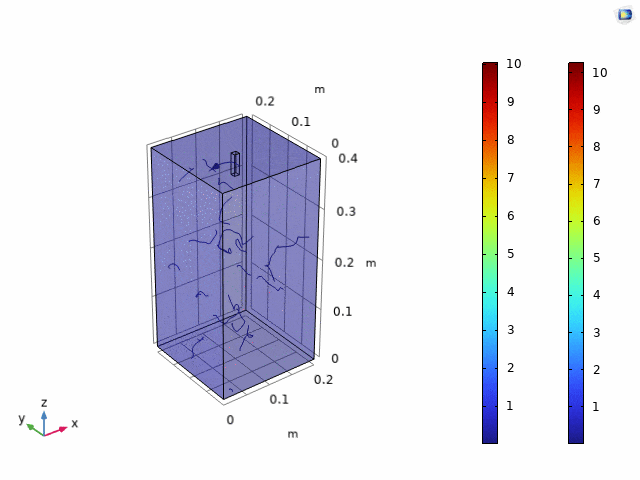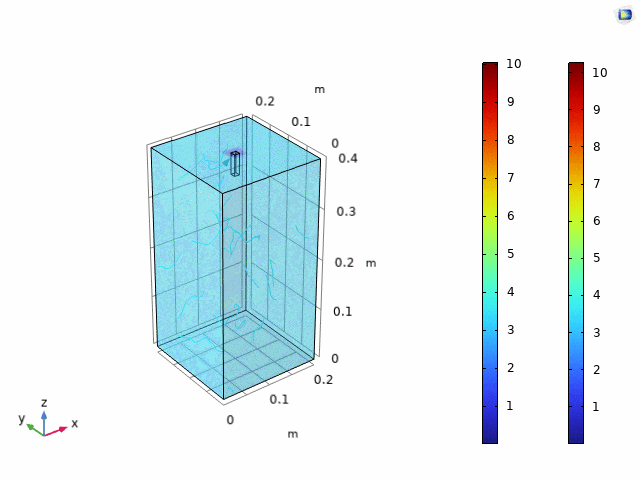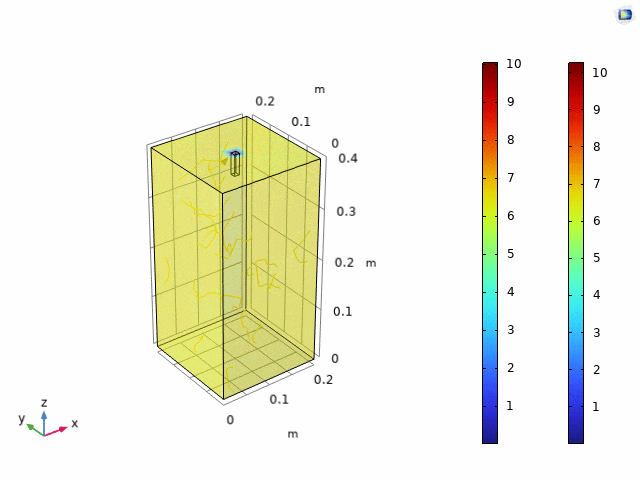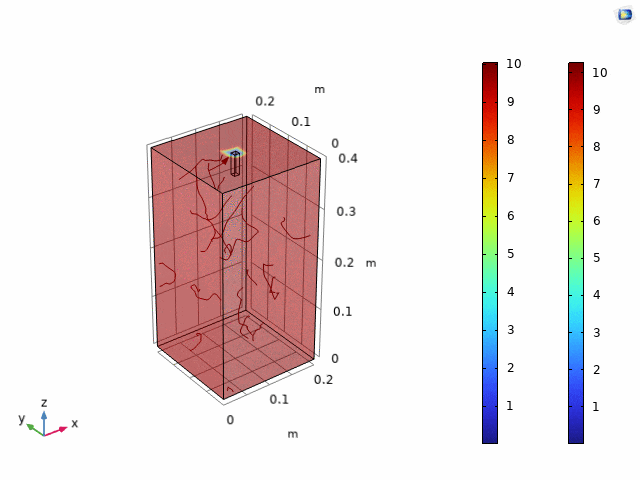
图3.11 三维模型荧光预测
此外,为了进一步模拟真实的点扩散模型,UCAS-China利用了一个二维横截面进行模拟。他们以容器的宽和高作为检测区域的长和宽。为模拟点扩散,他们设置了一个小半圆作为起始点,设定容器内壁上通量为0,并设定了初始扩散浓度,结果如下。效果符合预期。

图3.12 点扩散二维示意图
Model-e
在最后的板块,UCAS-China对建模所得的成果与湿实验所得到的数据进行了拟合。
首先,他们用计算机离散化的方法建模,预测阈值应为整体强度的0.6-0.8。因此湿实验组做了一系列实验寻找真实的阈值,并进一步修正模型更好的贴合有诱导剂时报告产物的增长系数。
此过程中,湿实验组用100-2000浓度梯度的激活子Activator(A),检测LuxR下游的GFP信号作为LuxR浓度结果,用如下的双对数散点图进行呈现。
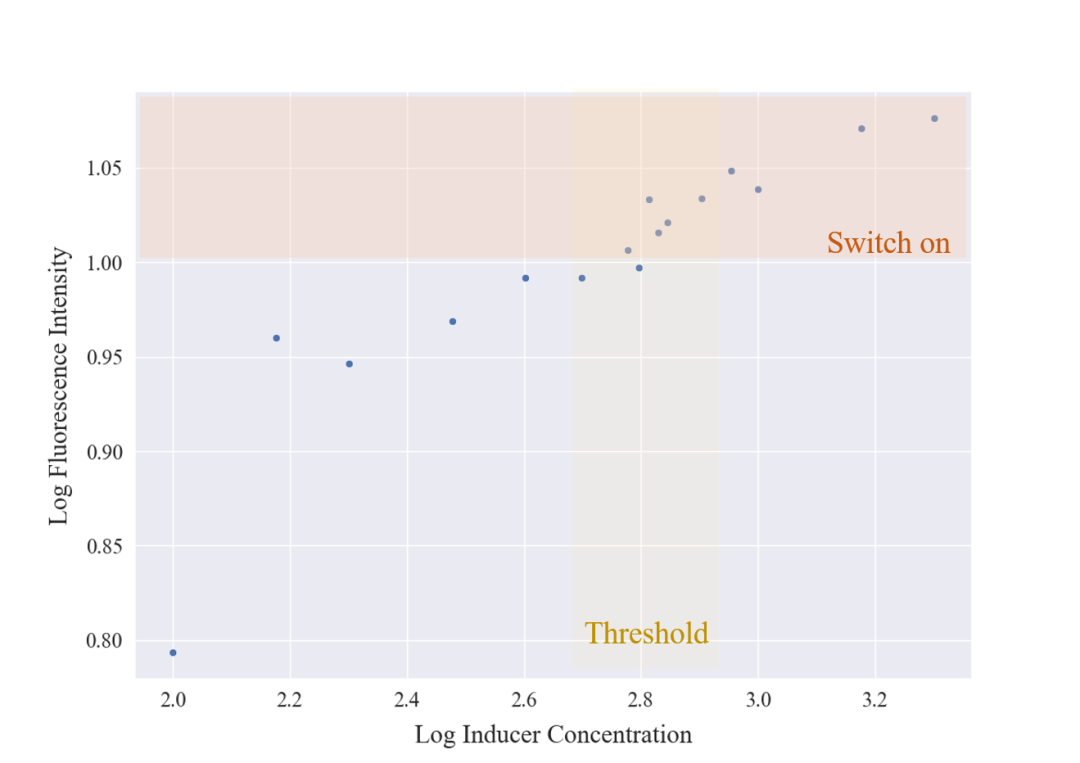
图3.13 荧光强度与诱导剂强度的关系
同时,UCAS-China再一次使用对数关系,对所获得的双对数散点图数据中报告基因产物(P)和诱导剂的数量关系进行拟合。处理结果如下。计算结果表明,inducer浓度在100-150之间斜率最大,开、关现象最明显,故指导湿实验使用100-150之间数值作为阈值。
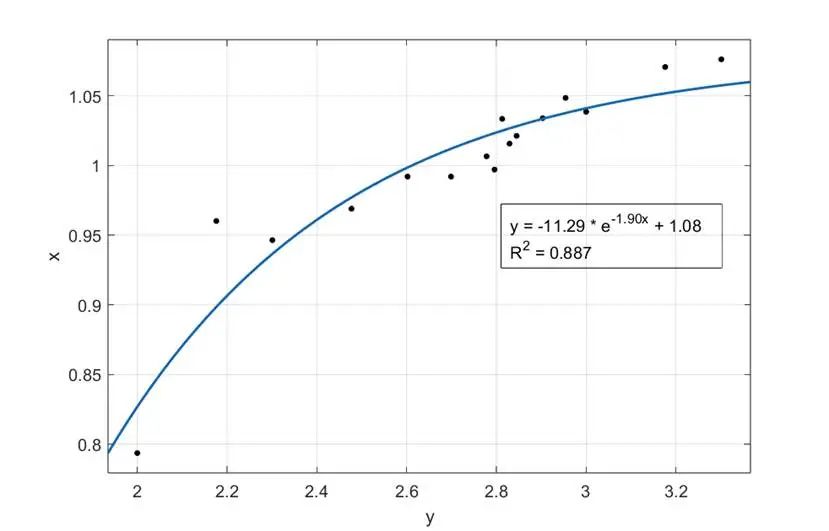
图3.14 湿实验室荧光强度与诱导剂强度的拟合曲线
然后UCAS-China用散点图数据进行拟合修正,结果如下。结果表明算得的抑制系数大于10倍,证明了开关的有效性。
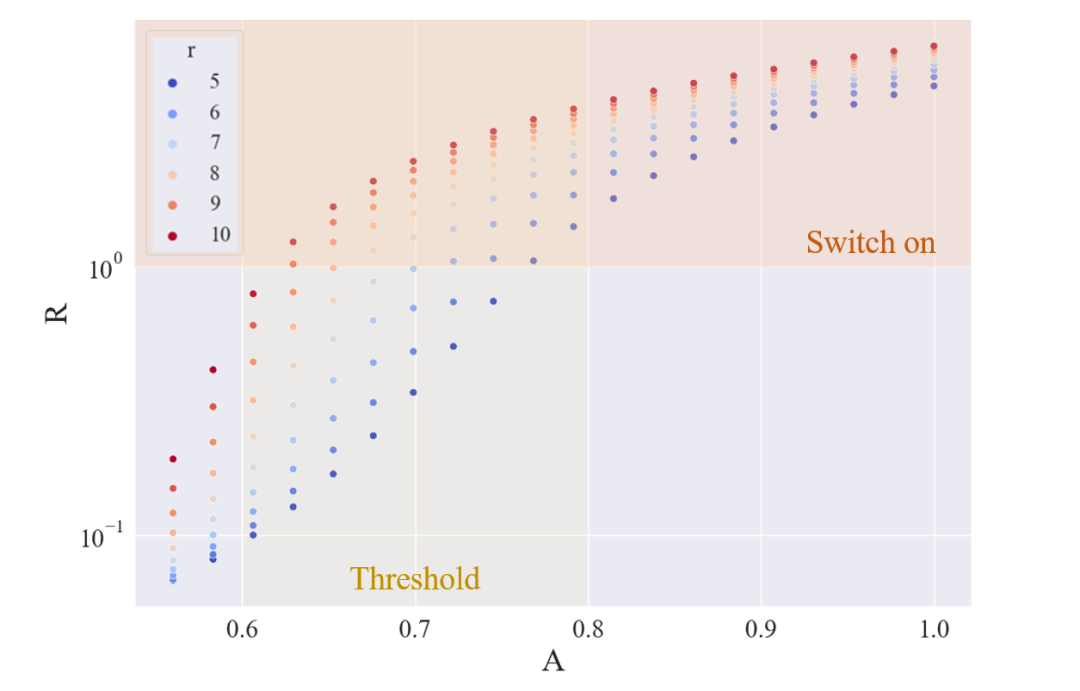
图3.15 湿实验数据与模型仿真的结合
同时,UCAS-China对相对荧光强度的衰减进行了预测。UCAS-China对四组实验组进行两类操作,产生8组不同体系的相对荧光强度衰减实验数据。基于这些数据,UCAS-China尝试了线性拟合。结果表明线性拟合效果良好。此外,他们还进一步确定了对应的衰减系数。
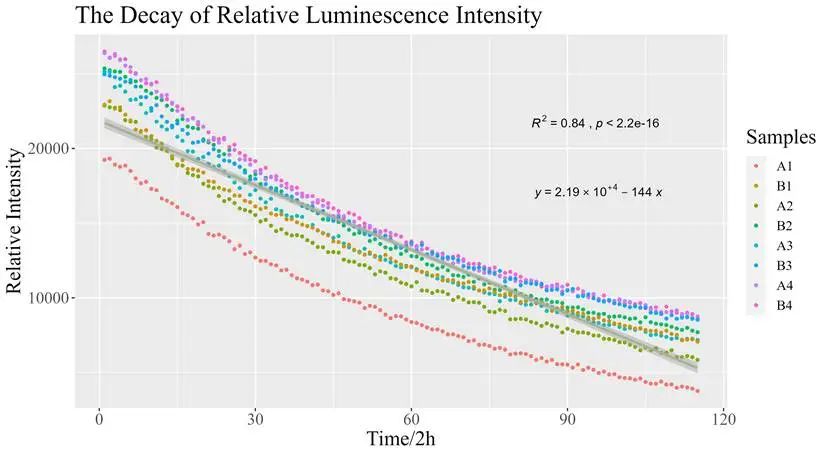
图3.16 相对荧光强度衰减的拟合曲线
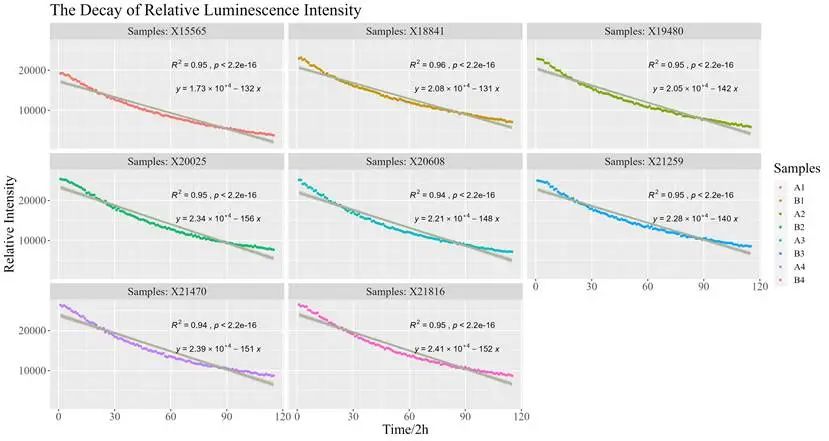
图3.17 各个体系衰减拟合曲线
Supplementary Model
开发了一些补充模型,用于进一步支持和优化整个项目的实验设计和理论分析。这些补充模型包括以下几个部分:
1.两个阈值实验
实验部分
目标:验证和优化双阈值开关的设计,确保其在特定诱导剂浓度下能够准确地触发和响应。方法:通过实验验证模型预测的阈值,并确定实际的阈值位置。
结果:通过实验数据拟合,确定了两个阈值分别位于 0.20-0.21 和 100,与模型预测一致。
原始数据可视化:绘制实验数据并显示误差条,直观展示阈值的存在。
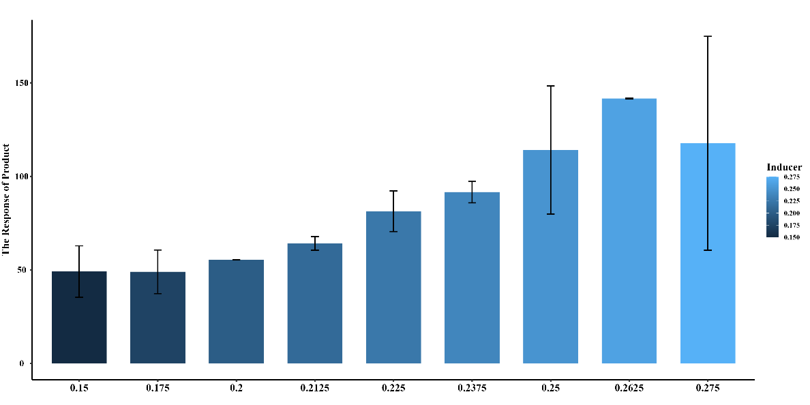
图3.18 PobR 的柱状图
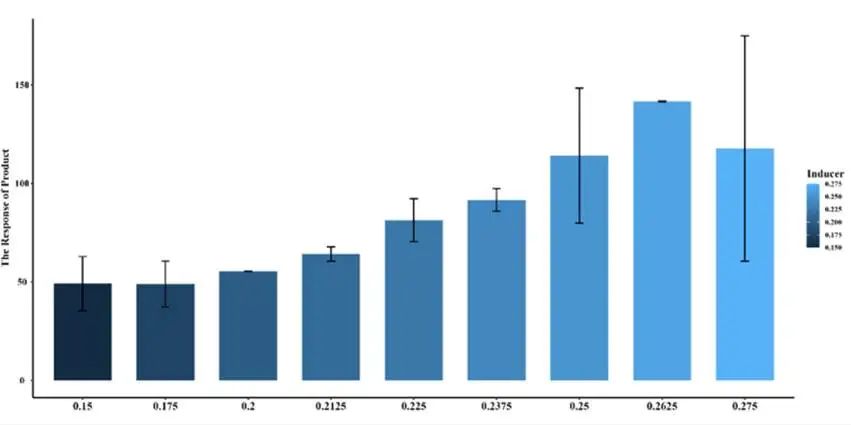
图3.19 XylS 的柱状图
数据拟合:对实验数据进行对数处理并进行指数拟合,建立开关特性曲线。
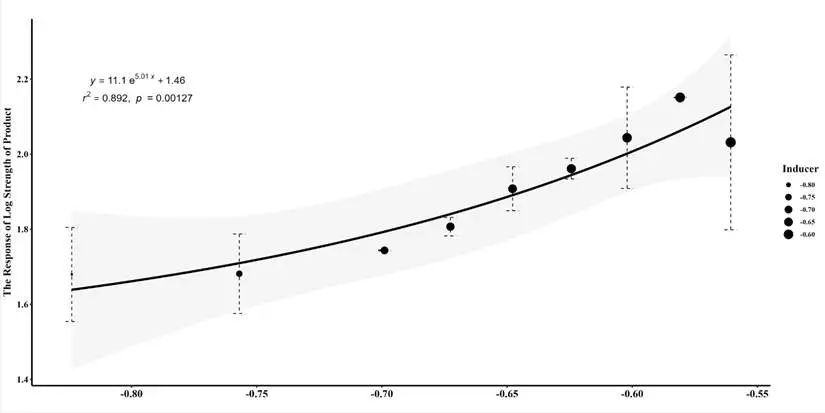
图3.20 XylS 的开关曲线
T 检验和阈值确定:通过成对 T 检验确定相邻组之间的 P 值,找到最低 P 值对应的阈值。
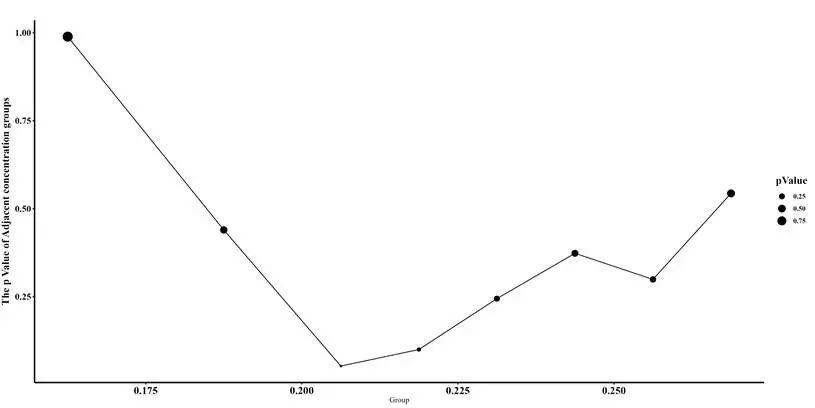
图 3.21 XylS 相邻组的 P 值
2. 整个级联反应的时间估计
反应规则: LuxI 合成:使用 Hill 方程描述 LuxI 的合成过程。
LuxI AHL 酶促反应:描述 LuxI 和 AHL 之间的酶促反应。
AHL LuxR-LuxR 复合物:描述 AHL 和 LuxR 之间的相互作用。
复合物激活基因和 GFP 产物:使用 Michaelis-Menten 方程描述复合物激活基因和 GFP 产物的过程。参数估计与测量。
参数来源:参考文献中的参数,并根据实验数据进行调整。通过实验测量荧光衰减率,调整模型参数。
时间估计:评估反应时间对参数的敏感性。使用信号流部分建立完整的反应链,调整参数以估计反应时间。估计的反应时间约为 15 分钟。
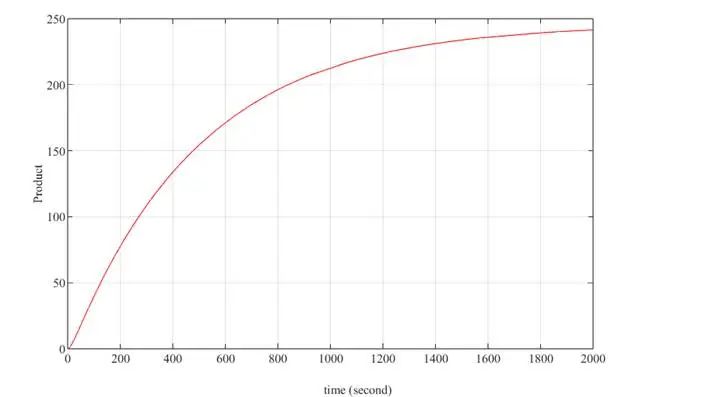
图3.22 时间估计
灵敏度分析:分析参数变化对最终荧光强度的影响。荧光本身的降解率、荧光生成的 Hill 系数、最大反应速率以及 LuxR 和 AHL 复合物的解释速率均对最终荧光强度有显著影响。
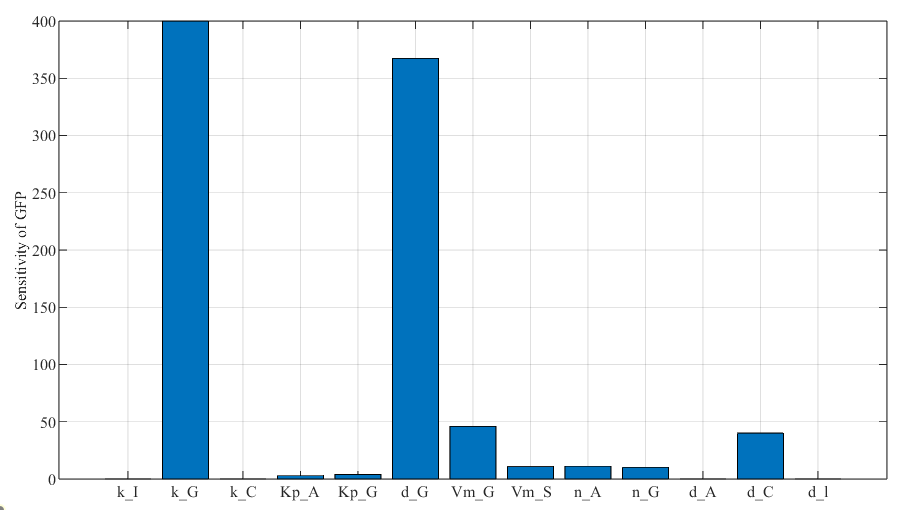
图3.23 最终发光浓度的灵敏度分析
DryLab---Hardware
NOX Kit是一款通用的生物实验环境检测硬件套件,提供温控、温度、生物发光监测功能。具有模块化设计;多种工作模式; 用户友好界面; 可重复的低成本设计四个特点
开发历程:在开发 NOX Kit 的过程中,UCAS-China进行了多次原型迭代,解决了许多实际问题,包括:通过优化反应室体积,减少试剂浪费和位置依赖效应;通过迭代检测元件,提高检测范围内的信号灵敏度;通过外壳设计和软件优化,提升用户操作体验。为了验证 NOX Kit 的设计是否能够实现预期的检测目标,UCAS-China与建模团队合作,使用 COMSOL Multiphysics 对反应室内的扩散和荧光进行了模拟。通过模拟,UCAS-China优化了反应室的几何形状、加热和光学传感设计,确保了硬件在实际应用中的性能。
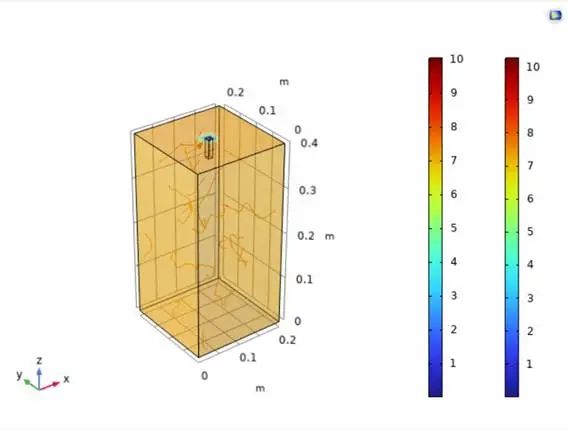
图3.24 COMSOL仿真结果
模块化设计
NOX Kit 包含以下主要功能模块:
核心板:使用 STC8G1K08A 微控制器、光电传感器和热敏电阻,实现生物发光和温度感应。
加热模块:可以选择 PTC 加热模块或半导体温控模块,提供精确的温度控制。
电源模块:支持 3.7V 锂电池、5V 直流电源或 5V USB 供电。
同时NOX Kit 的模块化设计允许未来扩展更多功能模块,例如显示模块,实现独立数据可视化。
工作模式:NOX Kit 可以在以下两种模式下工作
单检测器模式:通过串行通信直接与 PC 连接,作为独立检测器使用
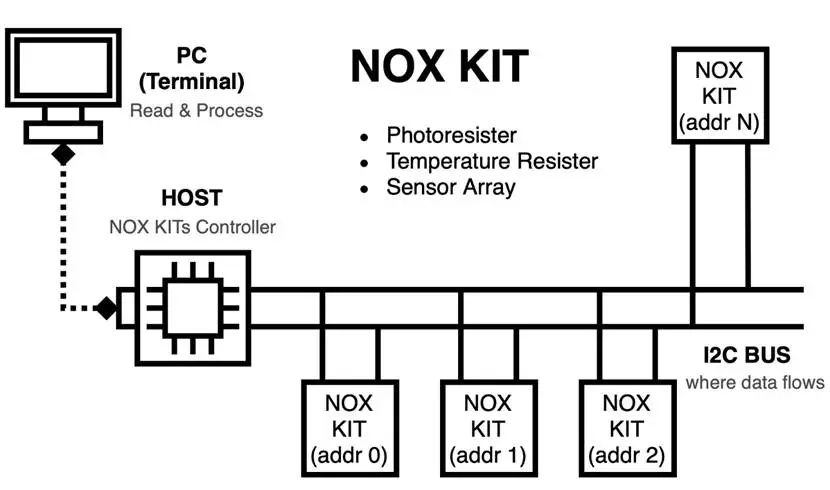
图3.25 通过I2C总线连接成阵列的NOX套件
用户界面:NOX Kit 提供了用户友好的数据采集和可视化工具:
NOX Monitor:一个图形化界面程序,用户可以通过简单的点击操作采集和可视化数据。
Python 接口:为开发者提供 Python 类库,方便集成和扩展。
低成本设计:
NOX Kit 的核心板成本低于 1 美元,通过使用低成本且易于获取的组件,结合生物放大技术,实现了高灵敏度的检测。此外,UCAS-China还提供了详细的电路图和 PCB 文件,用户可以通过简单的焊接工作自行组装 NOX Kit。
UCAS-China还提供了用户使用手册
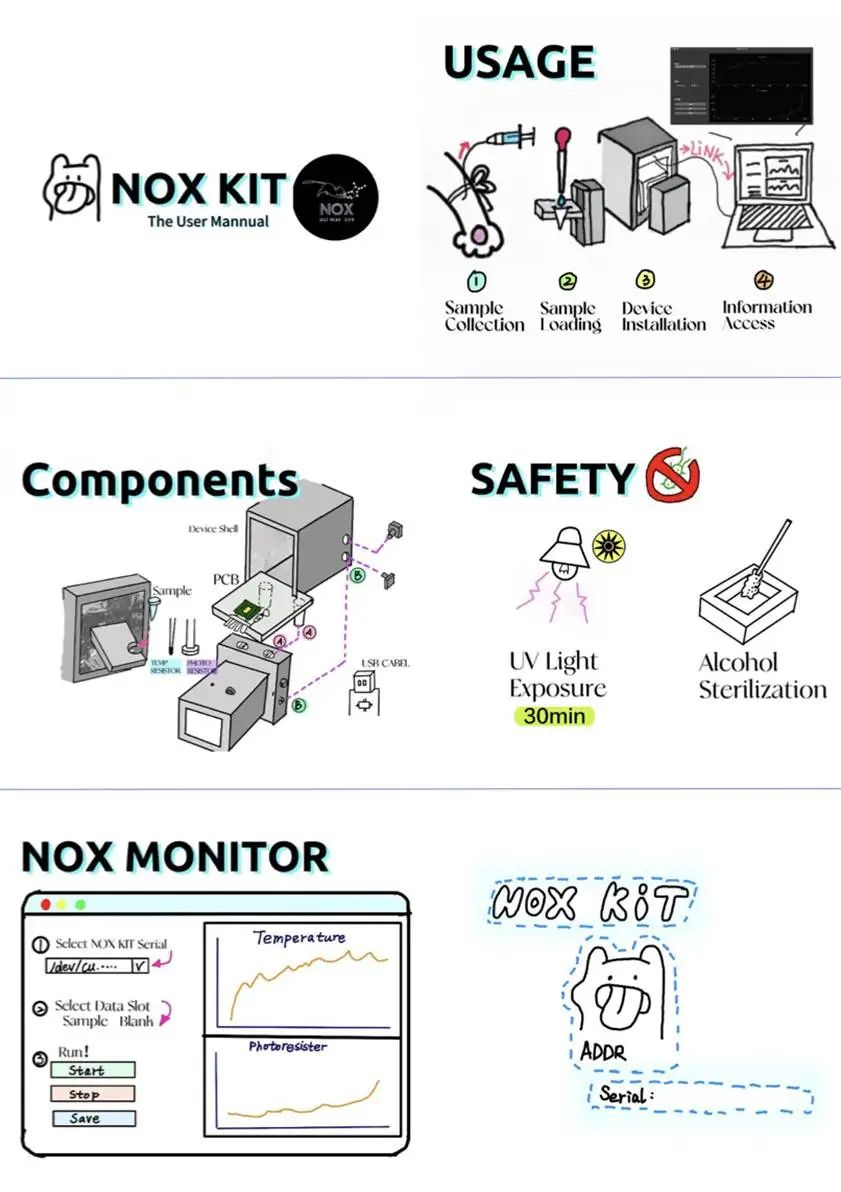
图3.26 NOX Kit使用指南
DryLab---Software
UCAS-China构建了名为“Ask NOX”的软件,可利用自然语言描述所需Biobrick的特征功能,帮助用户在iGEM数据库中快速筛选出所需的biobrick。
搜索用的自然语言案例:
·ATP-independent luciferase, very small (only 19 kDa), from a deep-sea shrimp.
·Quorum sensing, transcription factor, combine AHL.
·Quorum sensing, Synthesizes 3OC6HSL.
·Interacts with p-hydroxybenzoic acid, dual-directional.
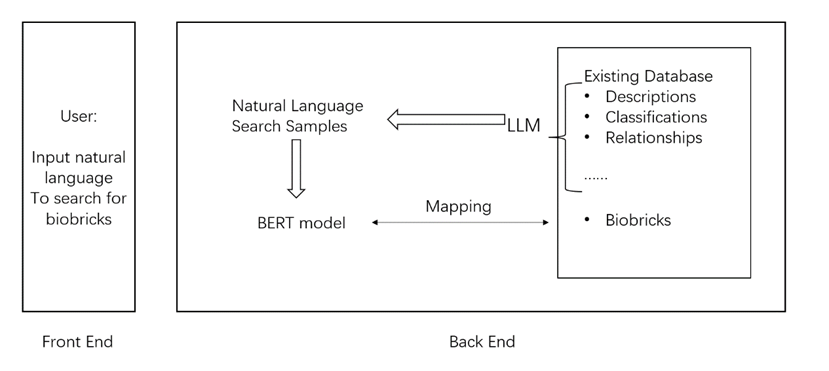
图3.17 软件结构
UCAS-China将该软件拆分为三个主要模块进行开发:
一、数据检索与处理。UCAS-China从parts.igem.org检索并获取了BioBricks的名字和相应描述,将大语言模型Llama2整合进工作流,使之扮演专业生物学家。该方法能有效给出符合自然语言描述的Biobricks。
二、BERT编码器。UCAS-China使用BERT编码器,成功基于自然语言编码了Biobricks。UCAS-China使用已有自然语言对Biobricks的描述作为训练数据库,构建了Biobricks的语义空间。同时BERT也能对用户的自然语言描述进行编码产生语义空间。通过BERT,UCAS-China实现了用户输入的自然语言与BioBricks描述语言的关联。
三、用户界面。UCAS-China在webpage中构建了用户友好型界面,用户仅需描述所需Biobrick,就能获得按照匹配率从上而下排列的Biobricks序列,并能看到各自相应的详细总结。此外,用户还能点击列表中对应链接,跳转到part.igem.org中相应液面获取更多信息。
具体的模型训练过程参见wiki中drylab的software部分。

Human Practices
HP部分他们以中国科学院大学(UCAS)人类实践循环为指导,积极向各个领域的专家征求意见,对公众和学生进行科普以培养他们对生物学或合成生物学的兴趣,并寻求合作以获取建议并产生更大影响。
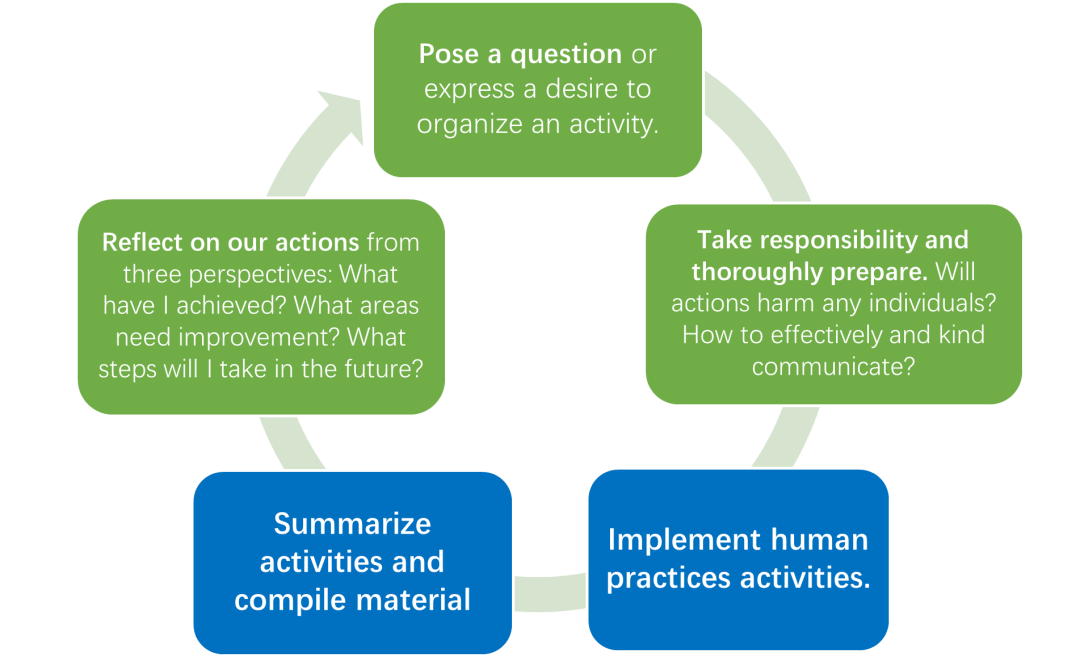
图4.1 中国科学院大学人类实践循环
团队围绕纳米抗体设计、检测设备开发、胆汁酸特异性识别、生物安全及技术转化等核心问题,与台湾中央研究院蔡耿璋教授、北京热景生物、中科院生物物理所刘平生教授、北京基因组所曾长青教授及中科院资本王仓博士等专家开展多轮深度交流。

图4.2 与北京热景生物公司交流会议

图4.3 与刘平生教授交流
通过这些专家教授的专业指导优化了融合蛋白折叠设计、检测设备可视化输出方案、非致病性大肠杆菌筛选标准及产品市场定位,最终形成包含用户手册、生物安全预案及低成本量产可行性评估的完整项目体系。评审会后团队进一步明确需加强生物安全处置机制、用户反馈收集及科学数据支撑,持续优化 NOX 检测平台的实用性与社会价值。
同时UCAS对于小学生、大学生和普通大众等不同层次的人群进行了教育科普活动,希望让更广泛的受众参与到科学、生物学或合成生物学领域

图4.4 针对农村小学进行科普教育

图4.5 针对大学生举办微生物绘画活动

图4.6 微生物绘画作品

图4.7 针对大学生开展合成生物学课程