陶瓷为何一摔就容易裂?为什么有些液体加热到有蒸汽出现需要的时间更少?气体的压力为何与温度有关?…
这些问题都和今天分享要说到的intermolecular forces有关!
而在今天的文章中我们即将解锁AP化学考试中的重中之重! 如果你看到AP化学考题知识点的题量分布,会发现所有单元的知识点大概题量都占总题量的7%—9%左右,唯独今天分享的这个单元intermolecular forces and properties(分子间作用力和性质)占了足足总题量的18%-22%(也侧面说明了,这一篇绝对讲不完……)先来看看本次干货内容的小目录,
今天的分享内容包括:
1Intermolecular forces(分子间作用力)
2Intermolecular Forces 对物体性质的影响
3Ideal Gas Law 4Kinetic Molecular Theory
01Intermolecular Forces(分子间作用力)
分子间作用力直接影响到了一个物质分子间的距离,和它们之间的紧密程度,也可以从物质的各种性质看出:boiling point, melting point等都和分子间作用力有直接关系。
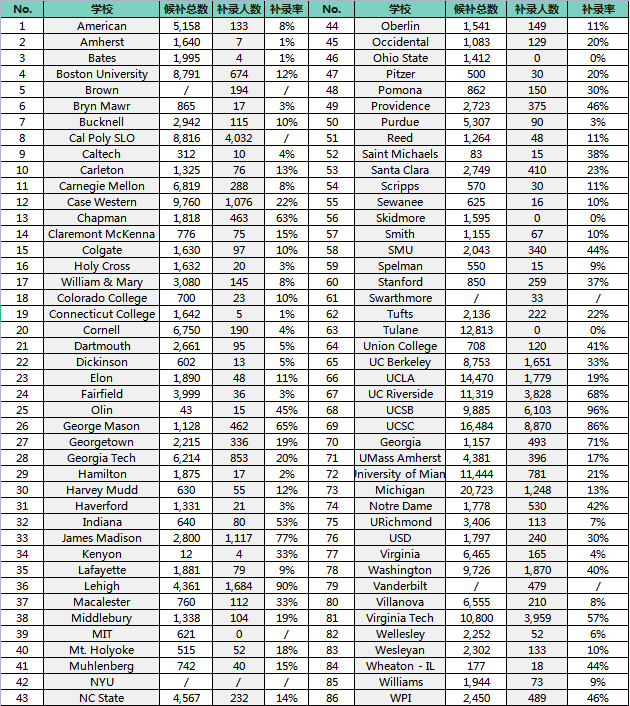
首先我们回忆一下dipole这个概念: 以HCl这个分子为例,因为H和Cl之间的electronegativity差距比较大,电子会比较往Cl那一边偏。于是H这一边是partially positive, Cl那边则是partially negative。
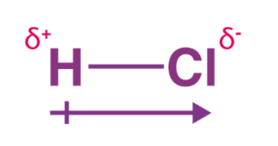
图1. HCl的dipole moment.
箭头指向的方向是电子聚集更多的地方(因此partially negative),加号对应的则是partially positive
复习了dipole的概念后,我们来看看这几种分子间的作用力:
1) Dipole-dipole attractions (取向力)
Polar molecules (也就是原子间electronegativity差距较大的分子)之间的作用力被称为dipole-dipole。 像图2里显示的,一个分子partially positive 的一段可能会和隔壁一个分子partially negative 的部分有一个比较弱的intermolecular interaction。 因此也可以推测出,一个分子的electronegativity difference越大,intermolecular force应该也是更大的。
图2. Dipole-dipole
HydrogenBonding
一个小提示:有一些教材会把Hydrogen Bonding 单独列为一种分子间作用力。其实它属于dipole-dipole,但因为hydrogen bonding比较特殊,也会被看为一种比较弱的covalent bond(还记得吗,这个知识点来自上次的分享。可以理解为分子间作用力强到像是同一个分子的原子间的作用力)。
对生物或者生物化学感兴趣的朋友会发现hydrogen bonding在生物相关的large molecules中会非常频繁地出现。
注意:hydrogen bonding只有是当H原子遇到了F、O或者N这种electronegativity值比较大的原子时才会出现,前面举例的HCl等都不属于有hydrogen bonding哦。(如果你记不清H只和N、O和F有这样的boding,有个说法叫H just wants to have FON……无法拒绝谐音梗的我决定让大家知道这句话。)
2) Dispersion Forces
London Dispersion Forces指的是fluctuating dipole之间的coulombic interaction。分子之间接触的范围越大,或者polarity越大,dispersion force就越大。因为电子并不是固定在一个位置,所以这个对于polar和non-polar 的分子都适用。
注意:虽然都是来自uncharged forces,London dispersion forces和van der Waals (vdW)并不是两个同样的概念!
目前我们把London dispersion forces 理解为vdW的一种。 结合这两种分子间作用力,我们也可以得出polarmolecules会普遍有更强的intermolecular force这一结论,因为它们同时有dipole-dipole和dispersion forces。
一个给想偷懒的同学们一个小总结,也给大家提供一些数据可以更直观地感受这几个intermolecular force之间需要能量的差距。这里的数值越小,intermolecular force就越大。 AP常考的集中intermolecular force之间的排列顺序是这样的:
- Dipole-dipole最强
- Hydrogen Bonding属于Dipole-dipole中最强的一种
- London dispersion forces 最弱
02Intermolecular Forces
对物体性质的影响 最明显的性质就是第二次知识点复习时给大家强调过的:同一种分子,它们间距离不同的时候决定物质是固体或是液体,或是气体。
AP会希望看到我们结合前面几种intermolecular forces,还有temperature,pressure等来分析一个物质的性质。 这里给大家以在固体状态下的NaCl(或者就是table salt)举例:
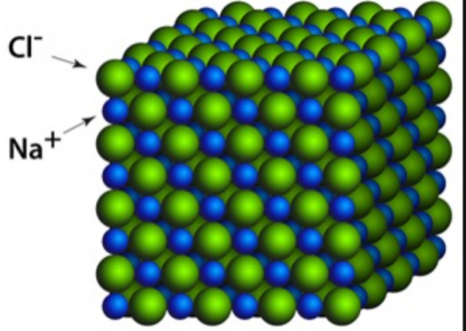
图3. NaCl的结构
我们先不考虑它为什么是这样排列的,放图只是想强调这个固体由钠离子和氯离子组成,也就解释了:
1.每一个NaCl都相对紧密,所以有stronger intermolecular force。也就是说我们要把这些分子分开需要更高的能量,也就可以引申到下一个性质:
2.Melting point 和 boiling point都比较高
3.因为是离子,所以尽管食盐无疑不导电,但当它溶于水,Na+和Cl-可以分开,离子相对自由移动的时候,溶液的导电能力会更强一些。 (这就可以解释开篇提到的问题,陶瓷容易碎是因为它的结构就是像NaCl这样由离子组成,像是一层一层摞在一起一样,靠positive和negative charge让彼此中间的intermolecular force更强。而一旦你一摔这个物体,某一层(或者这个plane)稍微移了位置,瞬间正负极就对不上了,于是摔出去的那个plane和它相邻的那个plane中间intermolecular force不够强,导致它回不去原来那个形态。)
03Ideal Gas Law
在国内上过初中的同学们对这个式子或许已经很熟悉了。
PV=nRT
其中P为pressure(单位:atm), V为volume(单位:m3),n为这个气体的量(单位:mol),R为常数(AP一般会在最前面的equations and constants sheet提供几个,其中8.314 J/mol·K,0.08206atm/mol·K这两个比较常用,大家根据自己已有的信息选择需要用哪一个),T为温度(单位:K)。 我们可能还会碰到同一个sample里有几种不同的气体的情况。这个时候如果要知道这个sample的总pressure,把几个partial pressure加在一起就好。用公式这么表达:
Ptotal = PA + PB + PC + ….
那反过来,如果想知道A的partial pressure应该怎么算呢?用这个公式:
PA= Ptotal * XA
XA代表mols of A/total mols。从微观的角度来看,就是在这个sample的所有分子中,有多少分子是A。 这些知识点在FRQ中也经常被一起考察。我们来看看这个选自2018年的AP Chemistry真题第四题:
看到这道题,我只想感叹,这个题简直仿佛是为我前面写的内容量身定做的配套练习题吧!! 这里有两个得分点:
1. Types 和 Relative Strengths
2. 它们的intermolecular force如何影响物体的性质
【官方答案】

CS2属于nonpolar,只有London dispersion force,而COS属于polar,因此LDF和dipole-dipole 都有。
看到第二段同学们或许会有些疑惑,前面不是说polar一般强一些吗,怎么到了这里CS2自己的LDF比 COS两种intermolecular forces加起来还强了。前面排列的顺序和这里的也对不上啊。 我个人刚学的时候也在这里感到疑惑。
保守的说法是:这得具体情况具体分析。一般来讲,LDF算是temporary dipoles,似乎会相对弱一些。 但至少在这一题里我们先知道结论:CS2的boiling point更高,注定它的intermolecular force会更强。(实在不会的时候先把这个结论蒙上去) 然后我们再从微观角度思考怎么解释这个结论。
可以回忆一下上次提到的lewis structure,S比O要多了8个电子,自然会有更大的electron cloud,它的permanent dipole就因此会强很多。 接下来我们来看下一小问:

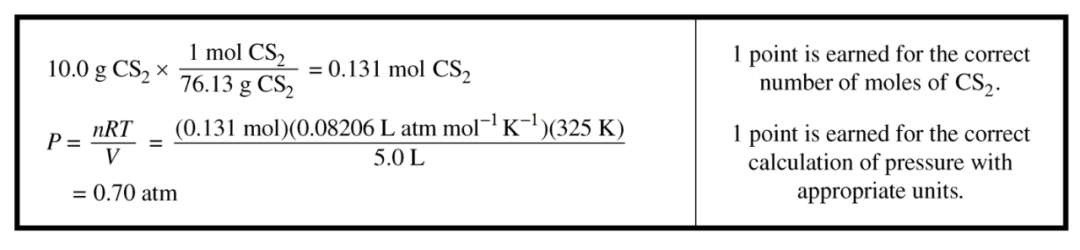
一看到pressure我们就知道,是时候用PV=nRT了。 两个得分点包括正确算出气体的量(mol)和最终的pressure。
有些同学喜欢一步到位,但个人建议还是先算出式子里每一个需要的数再套进去,既方便大家自己理清思路,也可以给改了上千份试卷头脑昏昏沉沉的判卷老师明确表示你拿到了得分点。 还有就是注意官方的单位标得多么清晰,这证明我每次啰嗦单位并不是空穴来风…
【官方答案】
04Kinetic Molecular Theory(KMT)
我们知道分子并不是固定在一个地方不变,而是一直在动的。而KMT这个理论就是主张气体的压力是由分子不停运动时彼此之间碰撞而产生的,而不是分子之间的正、负极的互相排斥。当然,温度和体积也会影响这个能量。 这一个知识点相对在选择题中间出现的比较多一些,也是掌握了公式往里套数值就可以。
KE=1/2 mv2
KE代表能量, kinetic energy(单位:J),m为物体的质量(单位:kg),v为物体移动的速度(单位:m/s)。
结 语
这一次我们复习了intermolecular forces的种类,它们之间的关系以及它们对物体性质的影响,并且以固体为例子做了一个分析。我们还复习了ideal gas law以及相关的公式。
下一期我们将会集中与solutions (所以除了水分子就是离子)来讨论intermolecular forces!期待一下哦~