文献标题:
1.Microbial anhydrobiosis
2.The Limits and Frontiers of Desiccation-Tolerant Life
3.Introduction to Bacterial Anhydrobiosis: A General Perspective and the Mechanisms of Desiccation-Associated Damage
4.Can microbial cells develop resistance to oxidative stress in antimicrobial photodynamic inactivation?
网址:
1.https://doi.org/10.1111/1462-2920.15699
2.https://doi.org/10.1093/icb/45.5.685
3.https://doi.org/10.3390/microorganisms10020432
4.https://doi.org/10.1016/j.drup.2017.07.003
关键词:
1.microorganisms; cellular water; anhydrobiosis; desiccation; rehydration process
2.desiccation; tolerence; drought; the limit of tolerence; gene
3.anhydrobiosis; desiccation; membrane lipids; nucleic acids; proteins; cellular water
4.Bacillus cereus group; Halophytes; Salt stress; Whole-genome sequencing (WGS); Comparative genomics; Secondary metabolites
主要内容:
1、干旱与渗透压[1]
文献中描述,干旱与渗透压为不一样的概念。人们(包括我们)容易混淆干燥、(部分)脱水和渗透压的定义。而且,干旱与渗透压对细胞的影响,以及压力机制是完全不同的。
事实上,“完全干燥”被定量定义为:含水量小于 0.1 g H2O泥土干质量的条件。[2]这大致相当于在50 % 相对湿度和 20 °C 的空气中干燥;对应于 0.50 的水分活度和 −100 MPa 的水势。而许多实验性“干燥”研究都是通过添加高浓度盐或溶质溶液作为降低水分活度的手段来进行的。这些代表性的例子,其实物理上存在水,只是其中大部分水是无法被生物所利用的。虽然高浓度的溶质使水的活度降低,但实际上体系中仍含有水分。只要有水分的存在,就能允许微生物运动,并促进营养物质的扩散。相比之下,干燥细胞中不存在大量水,细菌运动受到高度限制,这种情况和高浓度溶质的情况是完全不一样的。
由于我们主要锁定解决干旱的目标在长江流域一带,因此应当考虑该区域土壤的性质,并针对其性状下手,改善土壤保水能力,减少灌溉后的水分流失。据之前查找的资料,以江西为例,江西省红壤面积占土地总面积的70%以上,鄱阳湖区土壤多为砂土和红壤。虽然红壤的总持水量大,但有效水含量低,且发现红壤及砂土调控水分的能力也较弱。这就是导致江西干旱的主要原因之一 —— 土壤性状不佳,灌溉后水分流失过快,无法为农作物提供足够的水分。
*备注:这或许令人感到混乱,不过文献中有记录,细菌对渗透压的反应可能与缓慢干燥过程的第一阶段同义。另外,真实的环境条件与实验室的环境条件也有很大不同——在自然环境中,各种应激因素相互重叠,往往难以区分开来。因此,渗透压和干燥应力重叠也是十分常见的。[1]
2、微生物对干旱(干燥)的响应机制[3]
在干燥条件下,细胞(细菌)脱水有两个过程。部分脱水或者缓慢脱水时,细胞(细菌)外水分被去除。这导致外部环境中物质浓度的增加并导致渗透压增高。当发生极度脱水的时候,细胞(细菌)中大分子水化膜也会有所的损失。
文献中叙述了各种干燥对微生物的损伤,而事实上,失水一旦开始,各种损伤、以及细菌对其的应激措施都会启动。损伤可以体现在各种方面,例如,水分缺失导致细菌体内的充盈减少,细胞收缩,最终细胞本身变得更加“拥挤”。另外,各类离子和代谢物浓度的增加也会影响生化反应的循环。进一步,缩小的空间限制了分子的流动性,这又影响了代谢过程。其他损伤还有蛋白质变性、核酸损伤、膜脂结构被破坏等等。
值得注意的是一个“氧化应激反应”。文献中表示,干燥导致好氧细菌中产生异常大量的活性氧(ROS),例如过氧化氢H2O2,超氧阴离子O2-· , 或羟基自由基·OH,这将会促使细菌产生“氧化应激反应” 。顺带一提,ROS含量飙增情况可能是两种原因造成的。
ROS过量产生的第一个原因可能是:在干燥过程中,由于细菌逐渐失水,单个酶蛋白以及整个电子传输链都会受损,这导致细胞中和ROS的活动被抑制。研究证实了这一理论,结果表明呼吸率降低与脱水存活率之间呈正相关。同时也在酵母中测量到由于脱水导致的氧化过程增加了 10 倍。这说明,干燥的物理后果,如细胞皱缩、细胞内浓度增加、细胞质流动性降低,会促进 ROS 的积累。
ROS 过量产生的第二个原因可能是在细胞外水分耗尽期间和之后直接暴露于空气中。这可以解释为什么会有外源性 ROS 的出现,而且暴露在太阳辐射下也会影响 ROS 的产生。
由于已经知晓芽孢杆菌基因BH32中含有这一类氧化应激反应的片段,为了证实“利用细菌干燥失水导致的氧化应激反应,依靠检测细菌体内ROS的含量,来启动工程菌释放保水剂”这个想法的可行性,下面进一步查找细菌氧化应激反应的资料。着重点在于:对于干旱导致氧化应激的准确数据,细菌氧化应激反应的响应链,以及芽孢杆菌中BH32上的片段是否可行。
3、细菌的氧化应激反应[4]
由于细胞中的O2无法在代谢过程中正常地被还原形成H2O,过多的电子加到O2上,会产生一系列活性氧(ROS),例如超氧化物 (O2-· )、过氧化氢 (H2O2 )、羟基自由基(·OH) 等。一般情况下,细菌(尤其是好氧菌)正常的代谢过程中也会产生一些ROS,只是细菌体内清除ROS的系统可以调控自身体内ROS的浓度,使其不会危害自身。但是,当 ROS 与其清除系统之间的平衡受到干扰时,ROS 会在细胞内快速积聚,导致一种称为氧化应激的情况。文献中也叙述了氧化应激反应对细菌造成的损伤,引起氧化应激反应的其他因素等,这里主要着重于阅读细菌的氧化应激机制。
3.1 细菌的氧化应激传感和反应
前人研究较多的转录调节因子有:过氧化物响应调节因子 OxyR、PerR 和 OhrR。OxyR 和 PerR 主要是 H2O2传感器,而 OhrR 感测的是有机过氧化物 (ROOH) 和次氯酸钠(NaOCl)。OxyR 和 OhrR通过其结构中特定半胱氨酸残基的可逆氧化来感知氧化剂。相反,PerR则是通过组氨酸残基的铁催化氧化来感应H2O2的浓度变化。
3.1.1 大肠杆菌中的氧化应激机制
被氧化的OxyR蛋白在大肠杆菌中与RNA聚合酶共同结合,正向调节一组过氧化应激防御基因,如ahpCF、dps和katG(它们三个的表达也是被H2O2诱导的)。机制如下图所示,
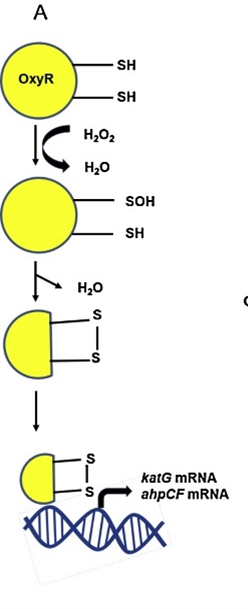
3.1.2 枯草芽孢杆菌中的氧化应激机制
PerR 是一种铁摄取阻遏物 (Fur) 同源物,在枯草芽孢杆菌中充当诱导型过氧化物应激反应的中央调节剂。PerR 先前已被证明可以调节mrgA、katA、ahpCF、hemAXCDBL和zosA基因。
在Zn2+(结构成分)存在的情况下,枯草杆菌的PerR能够感知细胞内的铁(Fe2+)/ 锰(Mn2+)的比例。虽然Fe2+介导PerR对过氧化物防御基因的调控,如katA、ahpCF和mrgA(dps的同源物),但在枯草杆菌中PerR的负向自动调控涉及Mn2+。尽管枯草杆菌PerR调节过氧化物防御基因,但PerR的转录不受H2O2的影响。相反,由H2O2压力引起的PerR蛋白的构象变化有助于PerR的调节功能。枯草杆菌PerR中两个组氨酸残基(即H37和H91)中的一个被H2O2氧化,导致Fe2+与PerR解离,去金属化的PerR不能再与DNA结合,所以PerR的这些构象变化诱导了基因表达。
3.2 引发细菌氧化应激机制的其他因素
顺带一提,引起氧化应激反应的其他因素有环境因素,如电离辐射、紫外线辐射,高温(导致高氧化应激)、低温,使用抗生素等(有抗生素的情况下,氧化应激反应是一种防御机制)。
参考文献
[1]J. Bosch et al., Microbial anhydrobiosis. Environmental Microbiology 23, 6377-6390 (2021).
[2]P. Alpert, The Limits and Frontiers of Desiccation-Tolerant Life1. Integrative and Comparative Biology 45, 685-695 (2005).
[3]T. Grzyb, A. Skłodowska, Introduction to Bacterial Anhydrobiosis: A General Perspective and the Mechanisms of Desiccation-Associated Damage. Microorganisms 10, 432 (2022).
[4]N. Kashef, M. R. Hamblin, Can microbial cells develop resistance to oxidative stress in antimicrobial photodynamic inactivation? Drug Resistance Updates 31, 31-42 (2017).