当我们开始学习化学, 我们就开始从微观的角度来观察和研究这个世界。今天AP知识点的总结里我们就从微观角度,或者原子层次上开始思考物质的组成。
本文目录
01原子结构 (Atomic Structure)
02电子组态 (Electron Configurations)
03元素周期表 (Periodic Table)
04摩尔和摩尔质量 (Moles and Molar Masses)
AP大考倒计时⏳更多AP学习辅导/帮助,欢迎扫码咨询顾问老师~
1、原子结构(Atomic Structure)
古希腊哲学家们管原子(atom)叫“atomos”,意为 “不可分割的”(似乎听上去有点浪漫呢?)。而从化学的角度来说,原子就是不可分割的一个物体的最小单位。
意思是说,当我们形容一个物质的化学组成时,原子是我们会使用的最小单位。 比如,一个水分子由两个氢原子和一个氧原子组成。然而,从物理角度来说,原子还是可以被继续“分割”。简单来说,原子由两个部分组成:
1)原子核(nucleus)由质子(protons)和中子(neutrons)两个更小的微粒而组成,占据一个原子的中心
2)电子(electrons)它们没有固定的位置,围绕着原子核有相对灵活的活动空间。我们也会称围绕着原子核的电子们为“electron clouds”,用来形容裹挟着整个原子核的所有电子的总和。
不过AP在这方面不做更多考察,我们只要知道这些即可。 但我们需要知道的是,质子为正极(positively charged), 中子为中性,因此原子核也为正极。电子为负极(negatively charged),而正负相吸这一点就解释了为什么电子围绕着原子核转:我们说它们被“attracted”。
2、电子组态(Electron Configurations)
2020的guideline说不写,但是2019及以前的AP都考察了这一个知识点,所以我决定还是简短带大家复习一下这个内容。AP的嘴骗人的鬼
每一个电子都占据一个orbital(轨域),分为s,p,d,f几种,对于它们分别的特征和如何区分在这里暂且不展开讨论。但可以确定的是,每一个orbital都至多只能存放两个电子,无论它属于哪一个种类。
初中的时候我们曾学到,围绕着原子核的电子们会从里到外一层层往外堆,并且每一层能存放的电子数都是有限的:第一层最多有2个电子,第二层最多有8个电子,第三层也是最多8个电子,以此类推(其实就是对应的元素周期表横排上有多少个元素)。
第一层只有两个电子,它们都在1s orbital里。第二层里有两个电子在s orbital,六个在p orbital(对应着元素周期表的最右边六个)。 先来看一个Electronic configuration的例子:
Oxygen (O) 1s22s2 2p4
【解析】
Orbital 前面的数字代表电子层,而右上角的数字代表对应的orbitals里有多少个electrons。所以这里就是一层的s orbital里有两个电子,2层的s orbital里有两个电子,p orbital里有四个电子。可以对应着元素周期表看,从1号的H开始一步步数过去。
对于原子,可以把右上角的数字加起来,如果总数对应不上这个原子的atomic number,那么我们就得重新考虑了:这是个离子吗?还是我们写错了? 我们使用electronic configuration的目的就在于,我们可以快速判断电子的分布情况。 我们也可以根据最外层电子数,最快锁定一个原子是否丢失或者获得某些电子,成为离子。
对于电子数比较多的,还有一种简便的写法(condensed configuration),先把前面最靠近你正在写electronic configuration的原子的noble gas写出来,再写出剩下的。比如O就应该是 [He]2s22p4。 这样做,我们也能更快速的看到最外层电子。 再给大家提供几个examples练练手,大家先做,写出完整的和condensed的,再看答案哈。
Nitrogen(N),Magnesium(Mg),Chlorine(Cl)
答案:N 1s22s22p5N [He] 2s22p5
Mg 1s22s22p63s2
Mg [Ne] 3s2
Cl 1s22s22p63s23p5
Cl [Ne] 3s23p5
3、元素周期表(Periodic Table)
元素周期表可谓是学化学绕不过的核心要点。 一个原子的质子数和电子数会很大程度上决定它的性质。而元素周期表参考每一个元素的内部结构来排列它们,同时也将同种性质的元素组合在了一起。
在AP考察的范畴里,这些元素大致被划分为(在元素周期表中也标志出来了):
Group 1 Alkali Metals
Group 2 Alkaline Metals
Group 3 - 12 Transitional Metals
Group 17 Halogens
Group 18 Nobel Gases
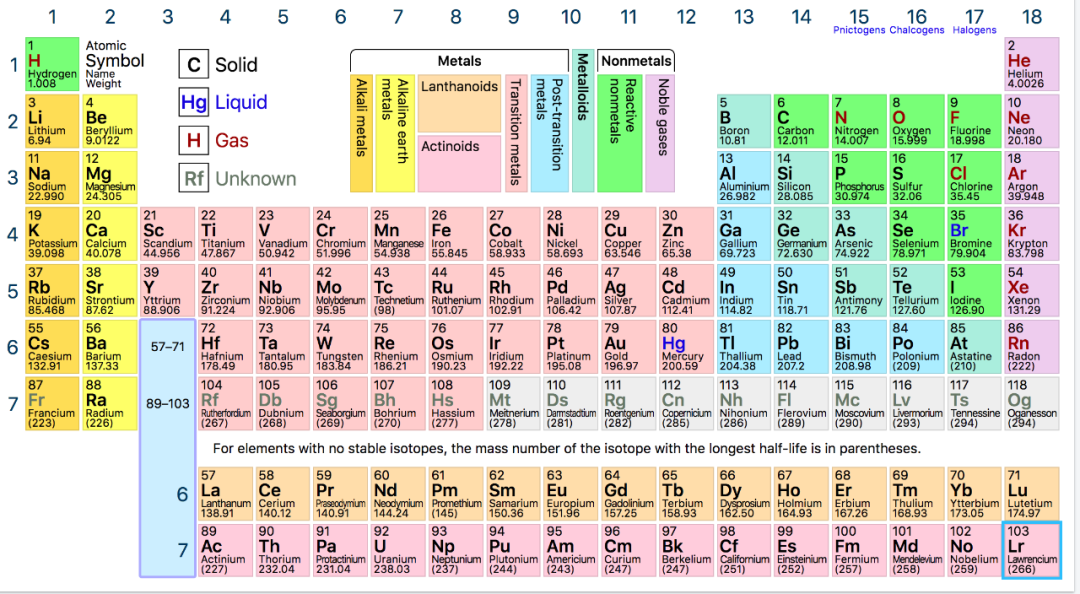
另外,元素周期表还有一个非常实用的用处,就是可以直观地反应元素性质的规律。
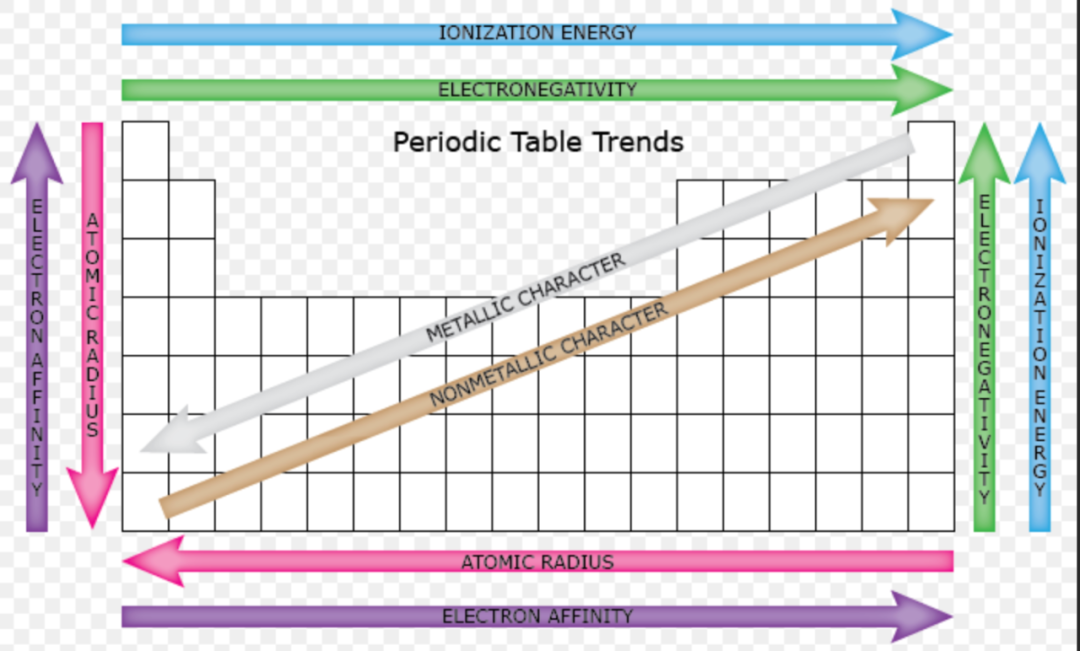
这张表对我们非常实用且重要。这些性质的规律能帮助我们预测多个不同元素的原子之间,在不同环境下的反应。我们可以复盘以下几个知识点,着手思考:
横排(period)的元素共同点在于它们的电子层数相同。
纵行的族(group)之间的共同点在于每个元素的最外层电子数(number of valence electrons)相同。
原子核为正极,电子为负极。
这几个简单的点可以解释一些规律。例如:
Atomic Radius(原子半径):
同一个period里,越往右(质子数越大),原子越小。这是因为原子核内的质子数越多,电子便会离原子核更近。想象原子核和电子分别为正极和负极的磁铁,一旦质子数变多,意味着这块正极的磁铁现在有更强的吸引力。 有些同学可能会提问,那电子也多了一个,为什么不变大呢? 这是因为一个电子太小,与这个吸引力相比仍然是后者影响更大。
4、摩尔和摩尔质量(Moles and Molar Masses)
Moles:一个可测量的物体由千万个原子组成, 一个个数无疑不太现实,再加上它们每一个的质量都轻到无法检测,我们只好用打包的方法从原子角度来算一个物质的质量。这个打包的单位叫做mole,适用于原子,离子,电子等任何粒子。
Avogadro’s number 就是指的1mole的物质里面所含的质子数,即6.02 *1023particles/mol。我们在之后会频繁的使用mol来计算某一个物质的质量,或者推断出某个物质里面的粒子数。 以Potassium(K)为例,我们知道1mol K的质量是39.098 g/mol,意味着一个mole单位的钾,或是6.02 *1023个钾原子加起来是这么重。
接下来有一些易混淆的概念:
1)Molecular Weight (g/mol)基本上和atomic weight的意思一样,只不过AW就是指1mol的某原子的质量,例如之前提到的钾,而molecular weight是指一个mol的某分子的质量。 例如H2O的molecular weight就是2mol * 1.01 g/mol + 1 mol * 16.00 g/mol = 18.02 g/mol。 这个对于由双原子分子(diatomic molecule)也同样适用,比如O2就是2mol * 16.00g/mol = 32.00 g/mol。
2)Atomic Mass Unit (amu)单看数值,amu值和molecular weight的值是相等的。但从概念上来讲,amu是从粒子的角度来考虑重量。
3)Molar Mass (g)质量;可以通过molecular weight和已知mol的个数算出。
4)Molar Concentration (M, mol/L)鉴于AP常结合这些知识点考Molar Concentration,我就也把这个概念放在这里。它是用来表示某一个溶液里面含某一个溶质的含量(也就是浓度),因此单位为M(mol/L),即一升溶液里有多少mol的溶质。 说了这么多,来看一个例题吧。这个题目来自AP 2019年考的FR 1c小问。

【解题步骤】
根据题目,我们知道了以下这些信息:
Urea ( H2NCONH2)的 Molecular Mass :60.06 g/mol
Urea ( H2NCONH2)的 Mass:5.39 gVolume of Water 0.05 L 我们需要算出的是这个溶液H2NCONH2的molar concentration,单位将会是M,即mol/L。我们已经知道了Volume(对应单位L)是0.05L,那么只需要算出有多少mol的H2NCONH2就可以啦!
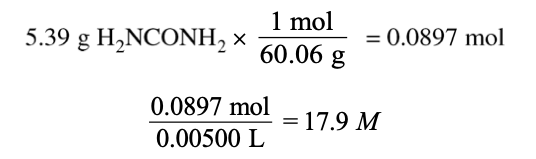
第一步算出numbers of mol,第二步算出molar concentration(M),这两步各为一个得分点哦。有些同学总是混淆g/mol到底是被乘还是被除。不妨用图里的这种方法, 一直都用乘,但是根据你最终想得到的单位决定把g还是mol放在分母一栏。比如例题里5.39g和60.06g的单位这样写就可以抵消,得到我们需要的mol。
如果这个题目里问,总共有多少个H2NCONH2分子,该怎么做呢?
思路是这样:求分子、或者任何粒子的个数,我们从这个单位可以推断出,我们需要使用Avogadro’s number来做这一题。 从题目中我们知道,总共有0.0897mol的H2NCONH2分子。0.0897mol H2NCONH2 * 6.02 *1023 molecules/mol = 5.40 * 1022 molecules答案就是 5.40 * 1022 molecules啦,注意不要忘记单位。
考试Tips
1. 元素周期表中period代表横排,group代表竖排,虽然很简单但容易混淆,同学们可以多加注意,或者根据题目的context推测。
2. Amu和molecular weight也是比较容易混淆的概念,虽然FR里面应该不会考到具体的,但是建议还是多复习一下Mole这个段落涉及到的概念!
3. 给习惯用电脑学习,或者手边没有实体教科书和资源的同学们推荐一个网站ptable.com (没有收钱!是真的好用),不仅有普通元素周期表会有的部分(atomic number, molecular weight等等),还可以看electron configuration,对于刚接触到的小白非常友好。